¿QUÉ ES EL TÉJIDO ADIPOSO ABDOMINAL? TODO LO QUE NECESITAS SABER SOBRE SUS RIESGOS

Autor Chimalli Digital
Un fenómeno que ha captado cada vez más interés es el hecho de que la forma del cuerpo, y en particular la distribución regional del tejido adiposo, es al menos tan relevante, si no más, que la cantidad total de grasa corporal para predecir las complicaciones que causan enfermedades tradicionalmente asociadas con la obesidad.
La proporción del tejido adiposo es un correlato clave y quizás un motor del riesgo para la salud relacionado con el sobrepeso y la obesidad.
La obesidad caracterizada por el tejido adiposo abdominal u obesidad visceral se ha establecido en la actualidad como parte de un fenotipo complejo que incluye disfunción en el almacenamiento de tejido adiposo y acumulación ectópica de triglicéridos en varios sitios, incluido el hígado.
La obesidad se define por un exceso de grasa corporal. En la práctica clínica, se ha evaluado comúnmente expresando el peso corporal en función de la altura, siendo el índice más utilizado el Índice de Masa Corporal (IMC), calculado como el peso en kilogramos dividido por la altura en metros cuadrados.
Donde un IMC muy bajo se asocia con un aumento de la mortalidad, incluso después de considerar el hecho de que puede ser un marcador de condiciones mórbidas subyacentes (por ejemplo, cánceres y otras enfermedades crónicas como la enfermedad pulmonar obstructiva crónica).
En el otro extremo del espectro, hay un aumento progresivo del riesgo de comorbilidades como hipertensión, dislipidemia, diabetes tipo 2, enfermedad cardiovascular (ECV), cálculos biliares y cánceres asociado con un aumento del IMC.
Los estudios poblacionales han establecido claramente el vínculo entre la obesidad definida por el IMC y el riesgo de comorbilidades/mortalidad, y varias organizaciones utilizan categorías de IMC para definir el bajo peso, peso normal, sobrepeso y diversas clases de obesidad.
Aunque el IMC es una herramienta adecuada para informar sobre las tendencias seculares en la prevalencia de la obesidad a nivel poblacional, sus limitaciones han dejado a los profesionales de la salud, en ocasiones, perplejos por el hecho de que la obesidad es una condición bastante heterogénea.
Las personas con sobrepeso u obesidad, como grupo, tienen claramente un mayor riesgo de comorbilidades en comparación con los individuos de peso normal.
No obstante, los médicos se han desconcertado por el hecho de que, mientras algunos pacientes obesos muestran claramente complicaciones asociadas con su exceso de grasa corporal, otros pacientes igualmente obesos no presentan las anomalías metabólicas esperadas a pesar de su significativo exceso de grasa corporal.
Dicho con otras palabras, la obesidad aumenta la probabilidad de presentar complicaciones, pero no todas las personas obesas las desarrollarán.
Al usar el IMC, uno debe confiar en la suposición de que el tejido adiposo está distribuido uniformemente por todo el cuerpo, lo que no toma en cuenta la heterogeneidad de la deposición de grasa corporal regional.
Un ejemplo sorprendente de las limitaciones del IMC se relaciona con el sujeto metabólicamente obeso, de peso normal (MONW), un concepto introducido originalmente por Ruderman y su equipo de científicos.
Estos individuos MONW, que tienen valores normales de IMC, no obstante, sufren de complicaciones metabólicas comúnmente encontradas en personas obesas.
Por el contrario, individuos obesos metabólicamente sanos (MHO) descritos por otros grupos de investigación tienen un IMC superior a pero no se caracterizan por resistencia a la insulina o dislipidemia.
Dichas observaciones sugieren que el alto riesgo de ECV puede observarse incluso por debajo del umbral normal de IMC de .
Un factor clave que subyace en la diferencia de riesgo de ECV entre individuos MONW y MHO es la probable presencia de exceso de tejido adiposo abdominal o visceral.
La mayoría de los individuos MONW con un IMC relativamente bajo probablemente tienen un exceso significativo de tejido adiposo abdominal, y la mayoría de los individuos MHO con un IMC alto probablemente tienen mucho menos tejido adiposo abdominal.
De manera similar, Matsuzawa y su equipo de investigadores han demostrado que personas muy obesas con una pequeña cantidad de adiposidad abdominal, como luchadores de sumo activos, son bastante sensibles a la insulina, mientras que los luchadores de sumo retirados y sedentarios con mayores cantidades de tejido adiposo abdominal tienden a ser resistentes a la insulina, dislipidémicos y tienen una alta prevalencia de complicaciones metabólicas como la diabetes tipo 2 y enfermedades cardiovasculares.
Por lo tanto, cuando llega el momento de evaluar el riesgo asociado con la obesidad en una persona, debe evaluarse la forma del cuerpo ya que es un factor esencial del riesgo de enfermedad asociado con cualquier cantidad dada de grasa corporal.
MECANISMOS BIOLÓGICOS DEL TEJIDO ADIPOSO ABDOMINAL
La naturaleza biológica y fisiológica de los tejidos adiposos situados en y alrededor de la cavidad abdominal pueden ayudar a descifrar los determinantes celulares de los patrones de distribución de la grasa corporal humana, así como la asociación fisiopatológica entre la obesidad con tejido adiposo abdominal y el riesgo cardiometabólico.
ROL CLAVE DE LA LOCALIZACIÓN DEL TEJIDO ADIPOSO EN LA SALUD

Shen y su equipo de investigadores publicaron un artículo detallado proponiendo una clasificación sistemática de la localización anatómica de los tejidos adiposos humanos.
El tejido adiposo corporal total se ha subdividido generalmente en dos componentes principales: tejido adiposo subcutáneo y tejido adiposo interno.
El tejido adiposo subcutáneo se define generalmente como la capa que se encuentra entre la piel y las aponeurosis y fascias de los músculos; generalmente incluyen el tejido adiposo mamario.
Un examen más detallado del depósito de tejido adiposo subcutáneo ha llevado a la identificación de dos comportamientos distintos, al menos en la región del tronco: una capa superficial de tejido adiposo distribuida uniformemente bajo la capa de piel abdominal y un compartimento más profundo de tejido adiposo subcutáneo, ubicado bajo la capa de tejido adiposo superficial.
Dichos compartimentos de grasa subcutánea abdominal anatómicamente distintos están separados por un plano fascial (denominado fascia superficial o subcutánea), que es circunferencial y se fusiona con la pared muscular subyacente en bandas radiantes en ubicaciones anatómicas particulares.
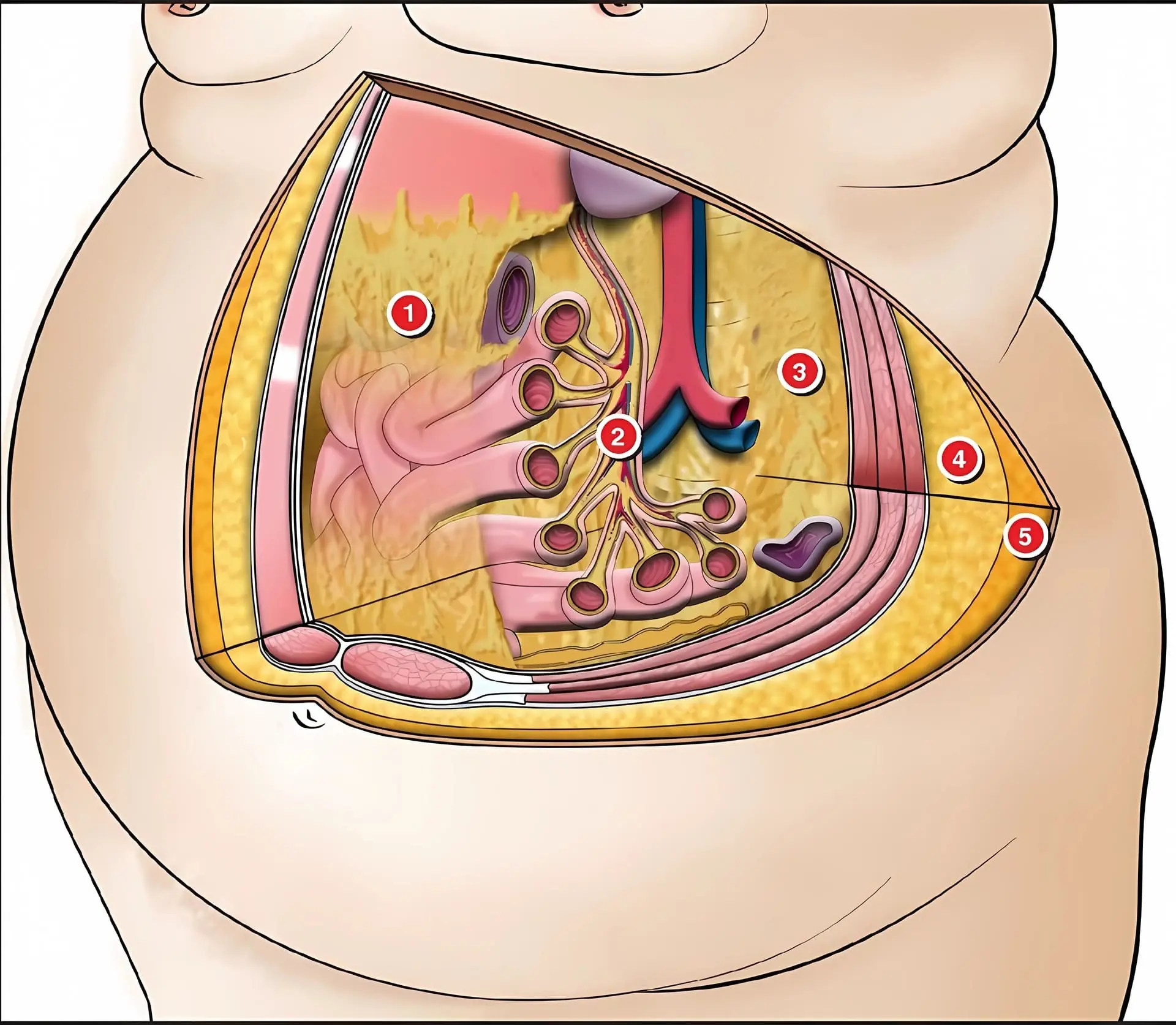
- Epiplón mayor – tejido adiposo omental
- Mesenterio – tejido adiposo mesentérico
- Tejido adiposo retroperitoneal
- Tejido adiposo subcutáneo profundo
- Tejido adiposo subcutáneo superficial
El tejido adiposo interno incluye el tejido adiposo intratorácico e intraabdominopélvico; el primero incluye el tejido adiposo pericárdico, mientras que el segundo incluye el tejido adiposo intraperitoneal y extraperitoneal.
El tejido adiposo intraperitoneal se compone de dos compartimentos principales: el epiplón mayor y el mesenterio; el tejido adiposo retroperitoneal incluye los tejidos adiposos preperitoneal y retroperitoneal.
Los estudios que utilizan métodos de imagen del abdomen generalmente se han centrado en la región abdominopélvica, y los límites anatómicos usuales han sido la pared muscular abdominal.
Así, el compartimento que corresponde a la denominación ampliamente utilizada de “tejido adiposo abdominal” generalmente ha incluido indistintamente el tejido adiposo omental, mesentérico y extraperitoneal.
Solo los tejidos adiposos intraperitoneales (principalmente los tejidos mesentérico y omental) son drenados por la vena porta, una característica que ha estado en el centro de algunas hipótesis que vinculan la acumulación de tejido adiposo visceral con la enfermedad metabólica.
Sumado a ello, los científicos han observado notables diferencias morfológicas entre estos compartimentos de tejido adiposo.
Específicamente, los lóbulos de grasa de la capa superficial del tejido adiposo subcutáneo están organizados de manera regular, mientras que los de la capa subcutánea profunda y los compartimentos internos, especialmente el epiplón mayor, son grandes, irregulares y menos organizados.
La vascularización, el flujo sanguíneo y la inervación también pueden ser bastante diferentes entre los diversos compartimentos, como se sugiere en otras publicaciones.
Evidentemente, surgen limitaciones metodológicas significativas a partir de dichas consideraciones anatómicas y morfológicas.
El estudio de la acumulación de tejido adiposo abdominal requiere el uso de técnicas de imagen como la TC o la RM, que no pueden distinguir con precisión cada compartimento anatómico.
Considerar todos los depósitos intraperitoneales como un solo compartimento con técnicas de imagen puede haber llevado a una subestimación de la asociación teórica entre la cantidad de grasa en cada subcompartimento y las alteraciones metabólicas.
Desde el punto de vista fisiológico, las muestras de tejido adiposo visceral son relativamente difíciles de obtener en humanos.
Para acceder a la cavidad abdominal, se requiere un procedimiento quirúrgico bajo anestesia general.
La gran mayoría de los estudios disponibles basados en cirugía se han centrado en el tejido adiposo omental.
IMPACTO EN EL TAMAÑO DEL ADIPOCITO DURANTE EL DESARROLLO DE LA OBESIDAD Y SU RELACIÓN CON LA SALUD

El tamaño de cada compartimento de grasa resulta de la integración del tamaño y número de adipocitos cargados de lípidos, que representan el componente celular principal del tejido adiposo.
En general, el tamaño medio de los adipocitos de todas las ubicaciones anatómicas y en ambos sexos aumenta junto con el nivel de adiposidad, pero alcanza una meseta en individuos con obesidad masiva.
Esta meseta sugiere indirectamente que la presencia de adipocitos grandes puede desencadenar la generación de nuevos adipocitos para almacenar el exceso de grasa dietética.
En consecuencia, el número de adipocitos se asocia positivamente con el nivel de adiposidad, y las poblaciones celulares del tejido adiposo parecen regenerarse constantemente durante la edad adulta.
Por otra parte, estudios que utilizan datación por 14C de adipocitos en adultos muestran que las bajas tasas de generación de nuevos adipocitos están asociadas con la hipertrofia del tejido adiposo, mientras que las altas tasas de generación están asociadas con la hiperplasia del tejido adiposo.
Por lo tanto, la incapacidad para aumentar la adipogénesis durante el aumento de peso en la edad adulta podría favorecer el desarrollo de células adiposas hipertróficas.
Como ya hemos mencionado, la celularidad del tejido adiposo está fuertemente influenciada por el sexo y la localización anatómica.
La asociación entre el número o tamaño de los adipocitos y el nivel de obesidad se modula en función de la localización anatómica y el sexo del donante de tejido.
Los compartimentos de grasa de la parte inferior del cuerpo de las mujeres obesas contienen más adipocitos que los de las mujeres delgadas, mientras que la obesidad no está relacionada con el número de células en los compartimentos de la parte inferior del cuerpo de los hombres.
Consistente con dichos hallazgos, un estudio longitudinal realizado en hombres y mujeres mostró que las células progenitoras de adipocitos de los compartimentos de grasa de la parte inferior del cuerpo pueden desarrollarse rápidamente en adipocitos maduros en respuesta a la sobrealimentación y que esta respuesta depende parcialmente del sexo del participante y del tamaño basal de los adipocitos.
Dichos resultados sugieren indirectamente que, durante el aumento de peso, los tejidos adiposos de la parte inferior del cuerpo tienden a expandirse a través de la hiperplasia en mujeres, pero a través de la hipertrofia en hombres.
En consecuencia, los adipocitos subcutáneos de la parte inferior del cuerpo de las mujeres tienden a ser más grandes que los de los hombres para cualquier nivel de adiposidad, mientras que las diferencias de sexo en el tamaño de los adipocitos subcutáneos abdominales son menos evidentes.
Con respecto al tamaño y número de adipocitos viscerales, los hombres delgados a moderadamente obesos tienden a tener adipocitos omentales más grandes que las mujeres.
En contraste, las células grasas omentales de las mujeres con obesidad masiva alcanzan un valor de diámetro celular máximo más alto (~130 μm) en comparación con los hombres con obesidad masiva (~120 μm).
En individuos delgados a moderadamente obesos de ambos sexos, los científicos observan una fuerte correlación entre el tamaño de los adipocitos subcutáneos abdominales y la masa grasa corporal total, lo que sugiere que la contribución de la hipertrofia de los adipocitos a la expansión del tejido adiposo abdominal puede ser similar en hombres y mujeres.
Como consecuencia lógica, los valores más altos de masa grasa subcutánea observados en mujeres en comparación con hombres pueden ser en parte atribuibles a un mayor número de adipocitos.
En mujeres adultas, la expresión de genes involucrados en la diferenciación de preadipocitos es relativamente mayor en el tejido adiposo subcutáneo que en el tejido adiposo visceral.
Adicionalmente, solo la expresión subcutánea de dichos genes se correlaciona con los valores de adiposidad.
Este hallazgo sugiere que, en mujeres, la expansión del depósito de tejido adiposo subcutáneo depende más de la hiperplasia de adipocitos que del compartimento de tejido adiposo visceral, que puede ser predominantemente hipertrófico.
En mujeres, los adipocitos omentales son entre un 20% y un 30% más pequeños que los adipocitos subcutáneos abdominales en gran parte del espectro de valores de adiposidad.
De hecho, los adipocitos omentales y subcutáneos abdominales solo tienden a alcanzar tamaños similares en valores de IMC muy altos (>60 kg/m^2).
Las mujeres también tienden a tener adipocitos más grandes en las regiones subcutáneas de la parte inferior del cuerpo en comparación con los sitios subcutáneos abdominales.
Interesantemente, a medida que las mujeres alcanzan la menopausia, las diferencias en el tamaño de los depósitos de adipocitos tienden a atenuarse ya que el tamaño de las células omentales parece aumentar específicamente.
La presencia de adipocitos omentales más grandes junto con el aumento de la acumulación de grasa visceral en mujeres posmenopáusicas sugiere que la deficiencia de hormonas ováricas puede afectar la hipertrofia de los adipocitos en este depósito.
En hombres, los adipocitos de los compartimentos de grasa visceral y subcutánea abdominal tienen tamaños similares en todo el rango de valores de adiposidad.
Esto sugiere que los adipocitos viscerales se vuelven tan grandes como, o incluso más grandes que, los adipocitos subcutáneos en hombres.
En conjunto, las diferencias regionales en el tamaño y número de células grasas reflejan la propensión de las mujeres premenopáusicas a almacenar más lípidos en los compartimentos subcutáneos de la parte inferior del cuerpo y abdominales mediante la hiperplasia de adipocitos, mientras que los depósitos de tejido adiposo visceral de los hombres (y las mujeres posmenopáusicas) son más propensos a manejar los lípidos entrantes a través de la hipertrofia de los adipocitos.
EFECTOS DE LA ACTIVIDAD METABÓLICA DEL TEJIDO ADIPOSO EN LA SALUD SISTÉMICA

El tamaño de los adipocitos es un determinante crítico de la función del tejido adiposo, independientemente de los niveles de obesidad.
La asociación entre la celularidad del tejido adiposo y las alteraciones metabólicas relacionadas con la obesidad también están bien establecidas.
El tamaño de los adipocitos subcutáneos está relacionado con medidas de resistencia a la insulina tanto en mujeres como en hombres.
La hipertrofia de los adipocitos subcutáneos es un factor de riesgo independiente para desarrollar diabetes tipo 2, independientemente de la adiposidad y la distribución de grasa corporal.
La caracterización detallada de la morfología de los adipocitos subcutáneos muestra que la hipertrofia del tejido adiposo está asociada con niveles más altos de insulina en ayunas y un índice HOMA-IR (modelo de evaluación de homeostasis de la resistencia a la insulina) independiente de la masa grasa corporal.
Ledoux y su equipo de científicos informaron que el tamaño de los adipocitos omentales está más estrechamente relacionado con las alteraciones de glucosa e insulina en personas obesas que el tamaño de los adipocitos subcutáneos.
Con respecto a las alteraciones de los lípidos en sangre, la hipertrofia de los adipocitos viscerales resulta ser un mejor predictor de los niveles de triglicéridos en plasma y en lipoproteínas de muy baja densidad (VLDL) y de una mayor relación colesterol total-colesterol HDL que la hipertrofia de los adipocitos subcutáneos.
Más aún, los científicos han hallado que solo la hipertrofia del tejido adiposo abdominal predice la hipertrigliceridemia en ayunas al controlar la composición corporal y la distribución de grasa en mujeres.
Los tamaños de los adipocitos en los compartimentos de tejido adiposo visceral y subcutáneo abdominal se han relacionado con la hipertensión.
Tales asociaciones del tamaño de las células grasas con los factores de riesgo cardiometabólicos probablemente surgen de cambios adversos en la función metabólica de los adipocitos agrandados en cada compartimento.
La hidrolisis de lipoproteínas ricas en triglicéridos catalizada por la lipoproteína lipasa (LPL) y la síntesis de triglicéridos son determinantes importantes del flujo de ácidos grasos y el almacenamiento de triglicéridos en un compartimento de grasa dado.
La mayoría de los estudios científicos que han incluido más hombres que mujeres han mostrado una mayor actividad de LPL en el tejido adiposo abdominal en comparación con la grasa subcutánea.
En contraste, la mayoría de los estudios científicos que han incluido más mujeres que hombres han encontrado una mayor actividad de LPL en el compartimento de grasa subcutánea en comparación con la grasa abdominal.
Por lo tanto, una gran parte de las diferencias regionales en la actividad de LPL se explica por el sexo de los participantes examinados.
Esto no excluye, sin embargo, que aparezcan algunas diferencias independientemente de las variaciones simples relacionadas con el sexo y la adiposidad en el tamaño de las células grasas.
Por ejemplo, en hombres la actividad LPL en el tejido adiposo es mayor en el tejido adiposo abdominal que en el subcutáneo, a pesar de que generalmente de observan tamaños similares de adipocitos en estos compartimentos de grasa.
En líneas generales, sin embargo, la actividad de LPL refleja el tamaño de las células grasas y varía con la propensión de cada compartimento de grasa a acumular lípidos en hombres y mujeres.
Otros estudios científicos se han centrado en las variaciones regionales en la acumulación de lípidos in vivo.
En mujeres, el almacenamiento de ácidos grasos derivados de las comidas aumenta en proporción a la masa grasa subcutánea de la parte inferior del cuerpo, mientras que no se encuentra asociación entre la absorción relativa de lípidos en la grasa subcutánea abdominal y las medidas de adiposidad.
Una preservación de la capacidad relativa para almacenar ácidos grasos en el tejido adiposo de las regiones del muslo y femoral con el aumento de la adiposidad puede promover el desarrollo del fenotipo de partición de grasa ginoide en mujeres.
En hombres, la capacidad de la grasa subcutánea abdominal para asimilar ácidos grasos es mayor en comparación con el depósito femoral.
Sumado a ello, una proporción significativa de la absorción de ácidos grasos ocurre en los tejidos adiposos abdominales de los hombres durante el periodo posprandial.
La evaluación indirecta de la absorción de lípidos en el tejido adiposo abdominal sugiere que este compartimento contribuye más significativamente a eliminar los ácidos grasos de la circulación en hombres que en mujeres.
Dichas observaciones fueron corroboradas con la medición directa in vivo de la absorción de ácidos grasos en cada compartimento de tejido adiposo abdominal que muestra que la absorción es un 30% mayor en la grasa abdominal en comparación con la grasa subcutánea de hombres jóvenes y saludables.
El flujo sanguíneo del tejido adiposo en el estado posprandial también puede representar un determinante importante de las diferencias regionales en la acumulación de lípidos.
Los científicos han observado un aumento del flujo sanguíneo en el tejido adiposo de la parte inferior del cuerpo después de la ingestión de comidas en mujeres, pero no en hombres.
Consistente con dichas observaciones, la síntesis de triglicéridos a partir de glucosa es menor en el tejido adiposo omental en comparación con el tejido adiposo subcutáneo abdominal en mujeres, pero es similar en ambos depósitos de grasa en hombres.
Dichos hallazgos sugieren que pueden estar en funcionamiento mecanismos ligeramente divergentes en la regulación de la acumulación de lípidos en cada compartimento de grasa.
También consistente con dicha hipótesis, la grasa femoral tiene un flujo de ácidos grasos menor que la grasa subcutánea abdominal y, en proporción, parece depender más de los ácidos grasos no esterificados del plasma y de los ácidos grasos derivados de los triglicéridos de las VLDL en comparación con la grasa abdominal, que depende más de los quilomicrones.
La acumulación de lípidos en un compartimento de grasa dado refleja el equilibrio entre la síntesis de triglicéridos y la tasa de lipólisis.
De nuevo, el tamaño de la célula grasa es un determinante crítico de la capacidad de respuesta lipolítica.
Análisis de poblaciones de adipocitos separadas según el tamaño de las células muestran que los adipocitos más grandes tienen tasas basales y estimuladas de lipolisis más altas.
Numerosos estudios científicos han informado de una lipolisis basal más alta en células adiposas subcutáneas comparadas con las células subcutáneas abdominales omentales, con pocas excepciones, independientemente del sexo y del grado de adiposidad de la persona.
En los depósitos de grasa de la parten inferior del cuerpo, la lipolisis se reduce casi por completo con altas dosis de insulina, mientras que la lipolisis del tejido adiposo abdominal solo se suprime a la mitad en estas condiciones.
Abundantes estudios in vivo han demostrado que el tejido adiposo subcutáneo de todo el cuerpo es la principal fuente de ácidos grasos no esterificados circulantes, contribuyendo con más del 85% de la liberación sistémica de ácidos grasos no esterificados en diversas condiciones clínicas.
En individuos delgados, se predice que tan solo entre el 5% y el 10% de los ácidos grasos no esterificados liberados en la vena porta se originan de la lipólisis del tejido adiposo abdominal.
No obstante, con el aumento de la masa grasa abdominal, se predice que el tejido adiposo abdominal contribuye con casi el 50% de la liberación de ácidos grasos no esterificados en la vena porta.
La alimentación alta en grasas, que conduce a aumentos en la grasa abdominal y subcutánea, genera una estimulación muy significativa de la liberación nocturna de ácidos grasos no esterificados, lo que podría contribuir al exceso de ácidos grasos no esterificados en condiciones de alimentación alta en grasas.
En líneas generales, los estudios científicos disponibles sobre el metabolismo del tejido adiposo sugieren que el tamaño de los adipocitos es un determinante crucial de las diferencias regionales en el metabolismo de los lípidos.
Se observa una acumulación relativamente más eficiente de lípidos en los compartimentos de grasa abdominal en hombres en comparación con las mujeres.
La incapacidad para almacenar eficientemente los lípidos posprandiales probablemente contribuye al exceso de ácidos grasos no esterificados y al desarrollo subsecuente de alteraciones metabólicas.
Por otro lado, la proporción de ácidos grasos liberados de los tejidos adiposos abdominales aumenta con la obesidad visceral, posiblemente debido a la combinación de hipertrofia de los adipocitos abdominales y una mayor capacidad de respuesta lipolítica relativa a los estímulos lipolíticos positivos y una inhibición atenuada por la insulina específicamente en el tejido adiposo abdominal.
En consecuencia, los experimentos in vivo han demostrado que, mientras que la lipolisis del tejido adiposo abdominal representa una pequeña proporción de la liberación total de ácidos grasos no esterificados del cuerpo, la contribución de este depósito puede ser particularmente evidente en la fase nocturna y aumenta hasta aproximadamente el 50% junto con la acumulación de grasa visceral.
¿POR QUÉ ACUMULAMOS GRASA EN EL ABDOMEN? FACTORES CLAVE QUE DEBES CONOCER

La propensión a acumular grasa visceral de manera preferencial en condiciones de exceso de ingesta de energía varía considerablemente de un individuo a otro.
Los mecanismos que podrían explicar las asociaciones entre la adiposidad abdominal y el riesgo cardiometabólico probablemente implican muchos fenómenos y vías posible.
¿POR QUÉ LA GRASA ABDOMINAL AUMENTA CON LA EDAD?
Diversos estudios científicos han documentado cambios relacionados con la edad en la distribución del tejido adiposo, reflejados en un aumento de la relación cintura-cadera (WHR, por sus siglas en ingles).
En una muestra de 52,953 mujeres, los científicos observaron que el aumento de peso corporal asociado con la edad era más probable que se acumulara en el área abdominal que en el área gluteofemoral.
En otra muestra de voluntarios holandeses (hombres y mujeres), se encontró que la edad era un correlato fuerte de la acumulación selectiva de tejido adiposo abdominal, estimada por un aumento en la circunferencia de la cintura.
En individuos jóvenes (hombres y mujeres) y en mujeres de mediana edad, el exceso de energía se almacena preferentemente en depósitos de grasa subcutánea, aunque las reservas de grasa visceral también pueden aumentar selectivamente en algunos individuos genéticamente susceptibles.
En este sentido, se ha demostrado que la relación entre el tejido adiposo subcutáneo abdominal y el tejido adiposo visceral es marcadamente mayor en mujeres que en hombres y disminuye con la edad en ambos géneros.
En otro estudio, la edad se correlacionó positivamente con la adiposidad abdominal y negativamente con la cantidad de tejido adiposo subcutáneo abdominal.
DeNino y su equipo de científicos estimaron que, en mujeres no obesas, el área de tejido adiposo visceral evaluada mediante tomografía computarizada (TC) aumenta con la edad a una tasa de 2.36〖cm〗^2/año.
El aumento en la deposición de tejido adiposo abdominal con la edad es particularmente significativo entre hombres y mujeres posmenopáusicas que, en promedio, tienen hasta el doble de cantidad de tejido adiposo visceral que en las mujeres premenopáusicas.
No obstante, incluso en mujeres premenopáusicas de mediana edad, la deposición de tejido adiposo visceral fue mayor en comparación con las mujeres jóvenes, lo que sugiere que la edad se asocia con un aumento de la adiposidad abdominal en mujeres incluso antes del inicio de la menopausia.
En mujeres jóvenes premenopáusicas, se ha reportado que los cambios relacionados con la edad en el tejido visceral en relación con la grasa corporal total son mayores que el aumento en la grasa corporal total durante un periodo de seguimiento de 4 años, y este fenómeno se encontró independiente de la raza.
En un estudio de seguimiento de 7 años de mujeres premenopáusicas, se reportó un aumento del 30% en la adiposidad abdominal, aunque los índices de adiposidad total no cambiaron.
Durante el mismo periodo, la circunferencia de la cintura y la relación cintura-cadera (WHR) también aumentaron significativamente.
Adicionalmente, el aumento en la circunferencia de la cintura durante el seguimiento de 7 años predijo el aumento de la adiposidad abdominal.
Dicho hallazgo sugiere que monitorear los cambios en la circunferencia de la cintura a lo largo del tiempo podría ser útil en la práctica clínica para detectar cambios en la adiposidad abdominal.
Dicho estudio proporciona más evidencia de que los médicos clínicos deberían mirar más allá de las mediciones de peso corporal y el IMC para evaluar adecuadamente si los pacientes están acumulando grasa abdominal y visceral con el tiempo.
La prevalencia de enfermedades cardiovasculares (ECV) aumenta con la edad y el mayor número de factores de riesgo de ECV en personas mayores en comparación con las más jóvenes explica en parte este fenómeno.
Por ejemplo, se ha demostrado que el aumento relacionado con la edad en la adiposidad abdominal es un correlato importante de las alteraciones en el metabolismo de lípidos y lipoproteínas y en la homeostasis de la glucosa plasmática en mujeres premenopáusicas de mediana edad en comparación con mujeres jóvenes.
Los resultados del estudio de seguimiento de 7 años en mujeres premenopáusicas también mostraron que el deterioro en los índices de homeostasis de glucosa e insulina plasmáticas reflejaba más de cerca el aumento relacionado con la edad en el tejido adiposo abdominal que el aumento en la adiposidad total.
Los hombres de mediana edad por lo general tienen un perfil de lípidos y lipoproteínas plasmáticas más aterogénico que los hombres jóvenes.
No obstante, cuando se compararon hombres de mediana edad con masa grasa corporal total y adiposidad visceral similar con hombres jóvenes adultos, muchas de las diferencias relacionadas con la edad en el perfil de lípidos y lipoproteínas plasmáticas se eliminaron, lo que sugiere que el aumento relacionado con la edad en la adiposidad total y visceral explicó muchas, pero no todas, de las variaciones asociadas a la edad en los niveles de lípidos y lipoproteínas.
Lemieux y su equipo de científicos han informado que la edad se asocia con un aumento en la concentración de partículas de LDL.
Tal aumento relacionado con la edad de las partículas pequeñas y densas de LDL observado en algunos individuos parece estar en gran medida relacionado con un aumento en los niveles de triglicéridos en ambos sexos.
Dado que la hipertrigliceridemia es otra consecuencia de la obesidad abdominal, estos resultados destacan la importancia de mantener bajos niveles de grasa visceral a lo largo del tiempo.
Los médicos clínicos deben ser conscientes del hecho de que el aumento en la adiposidad visceral con la edad predice un deterioro en el perfil de factores de riesgo de sus pacientes.
¿POR QUÉ LAS MUJERES Y LOS HOMBRES ACUMULAN GRASA EN EL ABDOMEN DE MANERA DIFERENTE?
Los hombres y las mujeres difieren significativamente en la distribución de la grasa corporal.
Los hombres tienden a acumular tejido adiposo en la parte superior del cuerpo (tronco, abdomen), mientras que las mujeres suelen acumularlo en la parte inferior del cuerpo (caderas, muslos).
Krotkiewski y su equipo de científicos sugirieron que las hormonas sexuales podrían estar involucradas en la regulación de las diferencias típicas de género en la distribución de la grasa corporal regional.
Su trabajo sugirió que dichas diferencias se deben principalmente al número de células grasas locales: los hombres tienen más células grasas en la región abdominal, mientras que las mujeres tienen más células grasas en los depósitos adiposos glúteos/femorales.
También observaron que dicha distribución regional del tejido adiposo no está relacionada con la presencia o ausencia de obesidad.
De acuerdo con las mediciones por tomografía computarizada (TC), la cantidad de tejido adiposo visceral es hasta el doble en hombres que en mujeres premenopáusicas.
En los hombres, la acumulación de tejido adiposo visceral generalmente aumenta con la cantidad de grasa corporal total, mientras que, en las mujeres, el volumen de tejido adiposo visceral se ve menos afectado por la cantidad de grasa corporal total en comparación con los hombres.
En otro estudio científico, incluso después de corregir por la masa grasa corporal total, las mujeres tenían una proporción menor de tejido adiposo visceral respecto a la masa grasa corporal total en comparación con los hombres.
El volumen total estimado de tejido adiposo visceral era de 5.23 +/- 3.29 litros en hombres y 3.61 +/- 1.91 litros en mujeres.
Las mujeres tenían menos tejido adiposo abdominal a pesar de tener valores más altos de IMC, grasa corporal total y tejido adiposo subcutáneo abdominal.
En consecuencia, las mujeres premenopáusicas acumularan una cantidad sustancial de grasa corporal total antes de que se observe una cantidad significativa de tejido adiposo visceral.
Mediante estudios de TC y MRI, varios grupos han probado la utilidad de la medición de la circunferencia de la cintura como un índice de la deposición de tejido abdominal tanto en hombres como en mujeres.
Para una determinada circunferencia de cintura, las mujeres por lo general tienen una mayor masa de grasa corporal y tejido adiposo subcutáneo abdominal que los hombres.
Sumado a ello, Kuk y su equipo de científicos demostraron que, para la misma circunferencia de cintura, los hombres tienen más tejido adiposo visceral que las mujeres.
También hallaron que, para un mismo aumento en el perímetro de la cintura, los hombres presentan una mayor acumulación de tejido adiposo visceral que las mujeres.
Kotani y su equipo de investigadores también notaron un claro dimorfismo sexual al comparar la distribución regional del tejido adiposo, en particular la acumulación de tejido adiposo abdominal, entre grupos de edad.
Por ejemplo, encontraron que la deposición de tejido adiposo abdominal aumenta con la edad, principalmente en hombres y en mujeres menopáusicas y posmenopáusicas.
La diferencia de género en el riesgo de enfermedades cardiovasculares (ECV) observada entre hombres y mujeres podría explicarse, al menos en parte, por la diferencia de género en la distribución de la grasa corporal.
Lemieux y su equipo de científicos han estudiado las diferencias de género en la adiposidad abdominal y el perfil de riesgo de ECV utilizando TC.
Encontraron que, aunque las mujeres premenopáusicas tienen más grasa corporal total que los hombres, también tienen una menor acumulación de tejido adiposo abdominal y un mejor perfil de riesgo metabólico.
Muchos estudios científicos han demostrado que altos niveles de partículas pequeñas y densas de LDL están asociados con un mayor riesgo de enfermedad coronaria (CHD).
El dimorfismo sexual en el tamaño de las partículas de LDL, con mujeres teniendo partículas de LDL más grandes que los hombres, también está bien establecido.
Carr y su equipo de investigadores sugirieron que una mayor actividad de la lipasa hepática en los hombres, que afecta la heterogeneidad de LDL y HDL y responde a la estimulación de la testosterona, también podría explicar la diferencia de género en el perfil de riesgo cardiovascular.
Adicionalmente al tamaño de LDL, el tamaño de las partículas HDL es otro marcador de la diferencia de género en el perfil lipídico circulante.
Las mujeres tienen partículas de HDL más grandes que los hombres, un fenotipo generalmente asociado con un perfil lipídico-lipoproteico de bajo riesgo.
En ambos sexos, el tamaño de las partículas de HDL se ha relacionado con factores de riesgo de ECV, como los niveles de triglicéridos, colesterol HDL y apolipoproteína B, así como con la relación colesterol/colesterol HDL.
En resumen, la tendencia de los hombres a acumular tejido adiposo visceral parece ser un factor clave para predecir por que la obesidad es mucho más peligrosa en los hombres que en las mujeres.
No obstante, las diferencias en la acumulación de tejido adiposo abdominal entre hombres y mujeres no pueden explicar completamente la diferencia de género en el perfil de riesgo metabólico.
Las hormonas sexuales pueden desempeñar un papel significativo en la modulación de los parámetros de riesgo metabólico más allá de sus efectos sobre la acumulación de grasa abdominal.
¿ESTÁ EN TUS GENES? CÓMO LA GENETICA INFLUYE EN LA GRASA ABDOMINAL

Los determinantes genéticos han sido intensamente estudiados en las últimas décadas. Estudios familiares han mostrado que las tasas de heredabilidad de la masa grasa corporal total son de aproximadamente el 50%.
Se ha generado y actualizado un Mapa del Gen de la Obesidad Humana durante varios años.
En las últimas actualizaciones, se habían identificado hasta 135 genes candidatos relacionados y/o asociados con fenotipos relacionado con la obesidad, además de 253 loci de rasgos cuantitativos.
Un estudio científico reciente sobre variantes genéticas relacionadas con la obesidad se realizó en cerca de 250,000 individuos en los que se genotiparon aproximadamente 2.8 millones de polimorfismos de nucleótido único (SNP).
Además de las variantes conocidas, este estudio identificó 18 nuevos loci relacionados con el IMC.
No obstante, el efecto combinado de estas variantes genéticas sobre la obesidad fue modesto, representando aproximadamente el 6%-11% de la variación genética en el IMC.
Por lo tanto, es probable que factores adicionales a las variantes de la secuencia de ADN expliquen las altas tasas de heredabilidad de la obesidad. Estos posiblemente incluyen interacciones gen-gen, interacciones gen-ambiente, así como la epigenética.
En cuanto a la distribución de la grasa corporal, se han reportado tasas de heredabilidad bastante altas.
De hecho, la transmisión familiar alcanza aproximadamente el 50% de la varianza ajustada por edad, sexo y grasa corporal total.
En esencia, los científicos han observado claras influencias genéticas a nivel de la obesidad general, la distribución de la grasa regional, así como la presencia de parámetros metabólicos alterados.
Esto subraya la naturaleza compleja de la contribución genética a la obesidad abdominal.
¿CÓMO AFECTA LA HORMONA DEL CRECIMIENTO A LA ACUMULACIÓN DE GRASA EN EL ABDOMEN?

Estudios en humanos han demostrado que los niveles o la secreción de la hormona del crecimiento (GH) están alterados en individuos con obesidad visceral y alto riesgo cardiometabólico.
Muchos informes sugieren que la asociación entre la obesidad abdominal es independiente de la adiposidad total.
De hecho, la adiposidad y la distribución de la grasa, junto con el envejecimiento y el entorno de esteroides sexuales, interactúan de manera muy compleja para modular la secreción de GH.
No obstante, también se ha demostrado que la pérdida de peso reduce el IGF-I y aumenta las concentraciones de la proteína de unión al factor de crecimiento similar a la insulina-3 (IGFBP-3), alterando así la asociación entre la acumulación de tejido adiposo abdominal y estos marcadores séricos.
Por lo que, no se entiende por completo si el perfil de secreción de GH atenuado observado entre los pacientes con obesidad abdominal es una causa o una consecuencia.
CÓMO LOS HÁBITOS ALIMENTICIOS CONTRIBUYEN A LA ACUMULACIÓN DE GRASA ABDOMINAL
Son pocos los estudios científicos que han identificado factores nutricionales que podrían predisponer a la acumulación especifica de grasa abdominal.
Estudios en ratas han mostrado que la ingesta de grasa saturada podría predisponer a una acumulación preferencial de grasa visceral en comparación con otros ácidos grasos.
La alimentación con grasa saturada en perros lleva a aumentos significativos en ambos compartimentos de grasa visceral y subcutánea.
En monos, la ingesta de ácidos grasos trans ha evidenciado un efecto especifico en la acumulación de grasa visceral que se asoció con el desarrollo de resistencia a la insulina, un hallazgo que también se observó en ratas.
En líneas generales, los estudios sobre la distribución de la grasa animal son difíciles de extrapolar a los humanos, en quienes el dimorfismo sexual en la distribución de la grasa es mucho más pronunciado.
Sumado a ello, demostrar que un nutriente dado modula la acumulación de grasa visceral no implica necesariamente un impacto especifico de este nutriente en la distribución de la grasa corporal.
De hecho, también se debe demostrar que un régimen cualitativamente distinto que incluya una cantidad similar de calorías no tiene el mismo efecto.
Un estudio de este tipo ha mostrado que la inclusión de grasa monoinsaturada en la dieta (dieta mediterránea) previno la ganancia de grasa abdominal dentro de un diseño isocalórico que incluía otros tipos de grasa dietéticas.
Consistente con este estudio, una gran encuesta epidemiológica ha mostrado que la adherencia a la dieta mediterránea se asoció con valores más bajos de circunferencia de cintura, independientemente del IMC en ambos sexos.
En promedio, la composición de ácidos grasos de la dieta puede tener un impacto en los patrones de distribución de la grasa corporal, además de su impacto en los niveles generales de adiposidad. Sin embargo, se necesitan más estudios para sustentar esta hipótesis.
El consumo de refrescos y la ingesta concomitante de fructosa se han convertido en un problema de salud pública en los últimos años.
Algunos metaanálisis sobre el tema de las bebidas azucaradas, la obesidad y el riesgo cardiometabólico han mostrado que el aumento del consumo de estas bebidas probablemente esté asociado con la obesidad, las alteraciones metabólicas y el desarrollo de diabetes tipo 2.
En su mayoría, los estudios disponibles demuestran que el consumo de fructosa aumenta los niveles de triglicéridos y glucosa en ayunas, estimula la deposición de triglicéridos en tejidos no adiposos (grasa ectópica), deteriora las respuestas de glucosa e insulina a un desafío oral de sacarosa y conduce a resistencia a la insulina hepática.
La fructosa tiene un impacto estimulante en la lipogénesis de novo hepática, lo que posiblemente explique su impacto en las respuestas de triglicéridos.
De manera bastante interesante, la fructosa aparece como uno de los pocos nutrientes que tienen un posible efecto en la distribución de la grasa corporal independiente de su impacto en la acumulación general de tejido adiposo.
De hecho, elegantes estudios en los que se dio a hombres y mujeres bebidas endulzadas con glucosa o fructosa que proporcionaban el 25% de los requerimientos energéticos durante 10 semanas mostraron un aumento especifico en la grasa abdominal en el grupo de tratamiento con fructosa.
Los mecanismos que explican este efecto aún no están claros, pero pueden involucrar una modulación específica del depósito de enzimas lipogénicas.
Se requieren más estudios para establecer si los patrones de distribución de la grasa corporal pueden ser influenciados por nutrientes específicos independientemente de su impacto en la adiposidad total.
SEDENTARISMO: UN FACTOR CLAVE EN EL AUMENTO DE LA GRASA ABDOMINAL

Un estilo de vida sedentario podría evidentemente hacer que un individuo sea más susceptible a un desequilibrio energético positivo cuando enfrenta una dieta contemporánea rica en alimentos procesados densos en energía y bebidas con azúcar.
No está claramente establecido si la falta de actividad física aumenta la susceptibilidad a la deposición selectiva de grasa abdominal.
No obstante, Ross y Janiszewski han revisado todos los estudios que informaron cambios no significativos en el peso corporal a partir de ensayos de ejercicio aleatorizados y no aleatorizados.
Los autores encontraron que la actividad física regular estaba asociada con una marcada reducción en la circunferencia de la cintura, incluso en estudios que no reportaron cambios estadísticamente significativos en el peso corporal.
La reducción significativa en la circunferencia de la cintura en ausencia de pérdida de peso fue acompañada en la mayoría de los estudios por mejoras en las variables de riesgo cardiometabólico.
Dichos resultados proporcionan alguna evidencia de que la actividad física/ejercicio regular podría reducir de manera selectiva o al menos preferencial la adiposidad abdominal.
Cuando examinaron selectivamente estudios que habían medido la cantidad de tejido adiposo visceral mediante técnicas de imagen, Ross y Janiszewski también encontraron que la actividad física/ejercicio regular podría inducir una reducción sustancial en la adiposidad visceral incluso en ausencia de pérdida de peso.
Estudios que han compensado el gasto energético de las sesiones de ejercicio con un aumento correspondiente en la ingesta de energía han mostrado una pérdida de tejido adiposo abdominal (entre -10% y -19%) asociada con programas de entrenamiento de ejercicio.
¿Cómo podría alguien perder tejido adiposo abdominal con entrenamiento de ejercicio físico sin perder peso?
Este hallazgo probablemente se explica por el hecho de que, bajo estas circunstancias, el ejercicio regular puede aumentar la masa libre de grasa.
Esta será la diferencia clave entre un déficit energético producido por la restricción calórica o por el ejercicio regular.
Por ejemplo, un balance energético negativo resultante de la restricción calórica y que induce pérdida de peso debería movilizar el depósito de grasa visceral probablemente en la misma medida que el ejercicio regular.
No obstante, el potencial para aumentar la masa grasa asociada con el ejercicio físico regular puede explicar la discordancia entre los cambios en el peso corporal y la adiposidad abdominal cuando se usa el ejercicio regular y no una dieta hipocalórica como modalidad para crear un déficit energético.
Desde un punto de vista biológico, la peculiar respuesta β-adrenérgica del tejido adiposo abdominal podría explicar la movilización selectiva y mayor de lípidos de este depósito en comparación con la grasa subcutánea, que es impulsada por el estímulo simpático asociado con el ejercicio vigoroso.
No se dispone de evidencia definitiva que apoye este posible mecanismo.
A pesar de eso, parece que, a partir de estudios transversales y ensayos de intervención con ejercicio físico, los individuos físicamente activos/entrenados tienen una proporción menor de tejido adiposo visceral que los individuos sedentarios/no en forma después de controlar su cantidad de grasa corporal total.
LAS PELIGROSAS CONSECUENCIAS DE LA GRASA ABDOMINAL: LO QUE DEBES SABER

CÓMO LA GRASA ABDOMINAL CONDUCE A LA RESISTENCIA A LA INSULINA Y DIABETES TIPO 2
Durante más de 20 años, la obesidad abdominal ha sido repetidamente asociada con la resistencia a la insulina, y se han publicado varios artículos científicos al respecto.
Recientemente, un estudio sobre aterosclerosis y resistencia a la insulina mostró que la circunferencia de la cintura era un fuerte predictor de la reducción de la acción periférica de la insulina en individuos delgados no diabéticos.
Wang y su equipo de científicos también confirmaron que la circunferencia de la cintura era un mejor predictor de la diabetes tipo 2 que la relación cintura-cadera (WHR) o el índice de masa corporal (IMC).
En un gran estudio internacional que involucró a 168,000 sujetos, Balkau y su equipo de investigadores demostraron claramente que dentro de cualquier categoría de IMC (“normal”, sobrepeso, obeso), había un aumento progresivo en la prevalencia de diabetes a lo largo de los quintiles de circunferencia de la cintura.
Adicionalmente, un estudio prospectivo realizado por Boyko y su equipo de científicos entre japoneses estadounidenses seguidos durante 6-10 años examinó la relación entre la medición directa de la adiposidad abdominal por tomografía computarizada (TC) y la incidencia de diabetes tipo 2.
Se encontró que el exceso de adiposidad abdominal precedía al desarrollo de diabetes tipo 2 en los japoneses estadounidenses.
En ese estudio, el tejido adiposo abdominal fue predictivo de la diabetes tipo 2 independientemente de la insulina en ayunas, la secreción de insulina, la glucemia, la adiposidad total y regional, y la historia familiar de diabetes.
Este estudio sugirió que el exceso de adiposidad abdominal podría ser un fenotipo clave de la adiposidad asociado con el desarrollo de la diabetes tipo 2.
GRASA ABDOMINAL Y DISLIPIDEMIA ATEROGÉNICA: CONSECUENCIAS PARA LA SALUD CARDIOVASCULAR

El estado dislipidémico que se observa frecuentemente en pacientes con obesidad abdominal es una característica clave de las anomalías agrupadas del síndrome metabólico y ha sido ampliamente descrito en la literatura.
Este estado incluye niveles elevados de triglicéridos, niveles bajos de colesterol de lipoproteína de alta densidad (HDL), niveles relativamente normales de colesterol total y de lipoproteína de baja densidad (LDL), pero con más partículas de LDL (cuantificadas por niveles altos de apolipoproteína B) que son más pequeñas y densas de lo normal.
En la obesidad abdominal, las partículas de HDL también son de tamaño pequeño debido a la presencia de hipertrigliceridemia.
Los niveles de colesterol total y de LDL suelen estar dentro del rango normal a menos que existan anomalías no relacionadas.
En un entorno clínico típico, la hipertrigliceridemia y el colesterol HDL bajo serán, por lo tanto, las dos principales anomalías sanguíneas detectables asociadas con la obesidad abdominal.
Tal como venimos mencionando el aumento en la proporción de partículas pequeñas y densas de LDL y HDL es un aspecto importante del estado dislipidémico frecuentemente observado en pacientes con obesidad abdominal.
Este fenómeno se debe a la remodelación de estas lipoproteínas en la circulación por enzimas como la proteína de transferencia de ésteres de colesterol y la lipasa hepática de triglicéridos.
Los científicos han demostrado que los intercambios de lípidos por la proteína de transferencia de ésteres de colesterol son impulsados en gran medida por la concentración de lipoproteínas donantes de triglicéridos.
Así, en presencia de hipertrigliceridemia, una mayor concentración de partículas grandes de VLDL1 promueve la transferencia de moléculas de triglicéridos a LDL y HDL a cambio de moléculas de éster de colesterol.
Como consecuencia, tanto las partículas de LDL como las de HDL enriquecidas con triglicéridos en pacientes con obesidad abdominal se convierten en buenos sustratos para la lipasa hepática de triglicéridos, lo que lleva al agotamiento del núcleo lipídico de estas lipoproteínas, formando así partículas pequeñas y densas de LDL y HDL.
Las HDL más pequeñas tienen un contenido reducido de éster de colesterol en su núcleo y se vuelven más sensibles a la degradación y al aumento de su eliminación de la sangre.
Este fenómeno explica en parte los bajos niveles de colesterol HDL que se encuentran frecuentemente en individuos con obesidad abdominal.
Cada componente de la dislipidemia aterogénica descrita podría contribuir, junto con muchos otros factores, al desarrollo de la aterosclerosis.
La hipertrigliceridemia per se ha sido propuesta como un factor de riesgo independiente para la aterosclerosis (es decir, riesgo no asociado con su impacto en la remodelación de LDL y HDL), pero este es un tema que continúa siendo debatido entre los científicos.
Los remanentes de lipoproteínas ricas en triglicéridos, que están elevados en estados hipertrigliceridémicos, son altamente aterogénicos, probablemente tanto como las LDL pequeñas y densas.
Varios factores podrían contribuir a la aterogenicidad de las partículas pequeñas y densas de LDL.
En primer lugar, las partículas pequeñas de LDL se unen de manera menos eficiente a los receptores de LDL, su ruta normal de eliminación, lo que aumenta su tiempo de permanencia y su número en la circulación, mientras que la resistencia a la insulina empeora la eliminación de LDL al reducir la capacidad de la insulina para estimular la expresión del receptor de LDL.
Dicho proceso favorece la unión de partículas pequeñas de LDL a la pared arterial.
En segundo lugar, los cambios de conformación en la apolipoproteína B en la superficie de las partículas pequeñas de LDL pueden hacerlas más propensas a interactuar con la superficie de las células endoteliales que recubren las arterias.
Esta retención y el menor tamaño de las partículas de LDL facilitan su entrada en la pared vascular.
En tercer lugar, las partículas pequeñas de LDL son muy sensibles a la modificación química (oxidación, etc.) una vez dentro de la pared arterial.
En Cuarto y último lugar, los receptores de los macrófagos residentes reconocen y absorben las LDL modificadas, lo que gradualmente convierte a estos macrófagos en células espumosas.
La formación de células espumosas es un paso temprano en el desarrollo de la placa aterosclerótica.
En contraste, el HDL podría ser antiaterogénico de varias maneras. Las partículas de HDL promueven el eflujo de colesterol desde la pared arterial (como lo hacen en todos los tejidos) y favorecen su transporte al hígado.
Las HDL también previenen la modificación química de las LDL dentro de la pared arterial, reduciendo así su absorción por los macrófagos.
Adicionalmente, las HDL obstaculizan los procesos que reclutan precursores de macrófagos (monocitos) a la pared arterial, reduciendo el número de células acumuladoras de lípidos allí.
También se ha demostrado que las partículas de HDL transportan moléculas que poseen propiedades antiinflamatorias, antitrombóticas y antioxidantes, lo que reduce la carga inflamatoria y oxidativa en la pared arterial, así como la formación de coágulos sanguíneos.
La combinación de triglicéridos altos, bajos niveles de colesterol HDL y partículas pequeñas y densas de LDL se ha denominado la “tríada lipídica aterogénica”; ha sido reconocida como un factor de riesgo mayor de enfermedades cardiovasculares.
Otra tríada de anomalías metabólicas que se encuentra con frecuencia entre individuos con obesidad abdominal, la tríada metabólica aterogénica de hiperinsulinemia, apolipoproteína B elevada y pequeñas partículas de LDL, ha demostrado aumentar el riesgo de cardiopatía coronaria en 20 veces en hombres de mediana edad, siendo este riesgo en gran medida independiente de los factores de riesgo tradicionales y las variables lipídicas en sangre.
En suma, el transporte del colesterol bajo la condición proaterogénica con frecuencia observada en la obesidad abdominal, los remanentes de quilomicrones, remanentes de VLDL y pequeñas LDL entregan colesterol a la pared arterial (proaterogénico), mientras que las HDL pueden proteger contra la aterosclerosis, pero solo parcialmente debido a sus propiedades de transporte inverso de colesterol.
La dislipidemia vinculada a la obesidad abdominal es un factor de mayor de riesgo de enfermedad cardiovascular y representa una de las anomalías sobre las cuales se basa la definición del síndrome metabólico.
COMO LA GRASA ABDOMINAL AUMENTA EL RIESGO DE ENFERMEDADES CARDIOVASCULARES

En base a la solida evidencia que relaciona la obesidad abdominal y el exceso de adiposidad abdominal con un estado dislipidémico aterogénico, se podría esperar una relación con resultados clínicos vasculares.
Por ejemplo, en el estudio prospectivo Heart Outcomes Prevention Evaluation realizado en hombres y mujeres con ECV estable, Dagenais y su equipo de científicos encontraron que el IMC ya no es un predictor independiente de infarto de miocardio después de ajustar por índices de obesidad abdominal como la relación cintura-cadera (WHR) y el perímetro de cintura.
Sumado a ello, el perímetro de la cintura y la WHR son predictores independientes de muerte por enfermad cardiovascular (ECV), infarto de miocardio y mortalidad total después de ajustar por factores de riesgo tradicionales y el IMC.
Otros estudios científicos realizados en sujetos ECV conocida también han informado que la WHR y el perímetro de la cintura son mejores predictores de la enfermedad coronaria que el IMC.
Por ejemplo, un estudio de seguimiento de 13 años de 792 hombres informó que una WHR elevada aumentó el riesgo de enfermedad cardiaca isquémica, mientras que los índices de obesidad total no tenían valor predictivo.
Los autores concluyeron que, aunque la asociación entre la WHR y el riesgo de ECV no era significativa en análisis multivariados cuando se tenían en cuenta los niveles de colesterol y la presión arterial, la WHR estaba más estrechamente relacionada con el riesgo de ECV que otros índices de obesidad, como el grosor de pliegue cutáneo o el IMC.
Un estudio prospectivo adicional realizado en mujeres también reportó hallazgos similares.
Este último estudio científico examinó si el fenotipo de andrógeno también aumento el riesgo de ECV en las mujeres.
Durante un seguimiento de 12 años, los científicos hallaron que la era un mejor predictor del infarto de miocardio en las mujeres que otros índices de la obesidad total.
Por consiguiente, el estudio concluyó que las mujeres con una distribución típicamente masculina de tejido adiposo podrían representar un subgrupo con alto riesgo de ECV.
En un análisis del Nurses’ Health Study realizado en una cohorte de más de 44,000 mujeres libres de enfermedad coronaria al inicio del estudio, Rexrode y su equipo de científicos examinaron la incidencia de 8 años de enfermedad coronaria entre los terciles de valores basales de IMC y perímetro de la cintura.
Dichos científicos hallaron que tanto la relación cintura-cadera (WHR) elevada como el perímetro de la cintura estaban independientemente asociados con un aumento del doble en el riesgo de enfermedad coronaria, incluso después de ajustar por hipertensión, diabetes y colesterol alto.
También informaron que los valores más altos del perímetro de la cintura aumentaban el riesgo de enfermedad coronaria, independientemente del tercil de IMC.
Más aún, encontraron que el riesgo de enfermedad coronaria de las mujeres con sobrepeso/obesas (IMC mayor o igual a 25.2 kg/m²) que no eran abdominalmente obesas (perímetro de la cintura menor a 73.7 cm) era similar al riesgo de enfermedad coronaria de las mujeres no obesas (IMC menor a 22.2 kg/m²) con niveles más altos de grasa abdominal (perímetro de la cintura mayor o igual a 81.8 cm).
Dichos hallazgos destacan particularmente la necesidad de ir más allá del peso corporal y el IMC y tener en cuenta la distribución del tejido adiposo al evaluar el riesgo de enfermedad coronaria.
Recientemente, la Emerging Risk Factors Collaboration ha publicado un importante análisis combinado que examinó el valor agregado de evaluar e interpretar el IMC, el perímetro de la cintura y la relación cintura-cadera (WHR) por separado o en combinación en la predicción del riesgo de ECV.
Los autores llegaron a la conclusión de que estas medidas de adiposidad no mejoran sustancialmente la predicción del riesgo de ECV en los países desarrollados cuando se dispone de información sobre factores de riesgo tradicionales como la presión arterial, la diabetes y los lípidos.
Estos hallazgos derivados del análisis de 221,934 participantes en 58 estudios prospectivos proporcionaron una sólida evidencia de que las simples medidas antropométricas de adiposidad no pueden reemplazar a la presión arterial, la historia de diabetes y las importantes variables lipídicas en la evaluación del riesgo de ECV.
No obstante, los científicos señalaron adecuadamente que tanto el perímetro de la cintura como el IMC están fuertemente asociados con estos factores de riesgo intermedios.
Por lo tanto, dado que la adiposidad elevada es una fuerza impulsora clave detrás del perfil alterado de factores de riesgo, sigue siendo importante prestar atención a estos índices de adiposidad en la práctica clínica para abordar la causa subyacente probable de la ECV: la obesidad abdominal.
Los científicos también cuestionaron la relevancia de medir el perímetro de la cintura, ya que los tres índices de adiposidad parecen predecir igualmente el riesgo de ECV. Tal conclusión conlleva el riesgo de abandonar la medición del perímetro de la cintura para volver al uso exclusivo del IMC.
Las recomendaciones derivadas de este hallazgo no son triviales y merecen cierta discusión. Primero, el perímetro de la cintura se confunde demasiado a menudo con un índice de adiposidad visceral independiente de la adiposidad total del cuerpo.
Como se muestra en numerosos estudios previos, la correlación entre el IMC y el perímetro de la cintura es fuerte.

Por lo tanto, cuando se considera como un índice antropométrico único, el perímetro de la cintura a menudo apenas supera al IMC como uno de los factores de riesgo.
Sin embargo, los científicos han demostrado previamente que el perímetro de la cintura es un discriminador útil del riesgo para un valor dado de IMC.
Así, el perímetro de la cintura es útil como un índice de adiposidad abdominal solo cuando el valor del IMC del paciente está disponible.
Por lo tanto, para dos pacientes con sobrepeso con el mismo valor de IMC (por ejemplo, 27 kg/m²), el paciente con una circunferencia de cintura de 98 cm probablemente tendrá más tejido adiposo visceral y más anomalías metabólicas diabetogénicas y aterogénicas que el paciente con un perímetro de cintura de 83 cm.
Esta información se pierde completamente si el IMC o el perímetro de la cintura se utilizan como índices de adiposidad únicos.
Así, si solo se mide el IMC, asumimos que la topografía de la adiposidad/grasa y el riesgo relacionado de estos dos pacientes es el mismo, lo cual es incorrecto.
Sin embargo, tal como han documentado los científicos, el perímetro de la cintura complementa al IMC, pero no debe reemplazarlo como índice único de adiposidad.
Resulta interesante notar que los investigadores de la Emerging Risk Factors Collaboration también informaron que los pacientes con diabetes tienen una cintura más grande para cualquier valor de IMC, un hallazgo totalmente concordante con la evidencia encontrada de que los pacientes con diabetes tipo 2 tienen más grasa visceral abdominal y más grasa ectópica que los individuos no diabéticos emparejados por IMC.
Por lo tanto, una cintura alta para un IMC dado es predictiva de un mayor riesgo, un hallazgo confirmado por los resultados de la Emerging Risk Factors Collaboration.
¿POR QUÉ LA GRASA ABDOMINAL AUMENTA EL RIESGO DE HIPERTENSIÓN?

La hipertensión es un poderoso factor de riesgo para una diversidad de complicaciones cardiovasculares como hipertrofia ventricular izquierda, arritmias auriculares y ventriculares, insuficiencia cardíaca diastólica, insuficiencia cardíaca sistólica y enfermedad cardíaca isquémica con o sin insuficiencia cardíaca congestiva.
Adicionalmente, la hipertensión daña el sistema nervioso central y los riñones.
La presencia de otros factores de riesgo, como la resistencia a la insulina y el síndrome metabólico, potencia el impacto perjudicial de la hipertensión en los órganos afectados y el riesgo de enfermedades cardiovasculares.
El vínculo entre la obesidad y la hipertensión ha sido reconocido desde hace mucho tiempo, con pacientes obesos presentando tasas más altas de hipertensión que los individuos con peso normal.
Curiosamente, no todos los pacientes obesos son hipertensos, lo que indica nuevamente la heterogeneidad de la obesidad desde el punto de vista vascular.
Los científicos han informado que el perímetro de la cintura es el predictor independiente más fuerte de la presión arterial sistólica y diastólica en individuos normoglucémicos chinos.
En un estudio basado en la población, del cual solo el 6,5% de los sujetos tenían hipertensión, Poirier y su equipo de investigadores observaron que el perímetro de la cintura en hombres y mujeres estaba más fuertemente vinculado a la presión arterial sistólica y diastólica en comparación con otros posibles contribuyentes como la resistencia a la insulina y los niveles de insulina en ayunas.
La cantidad de grasa visceral estimada de forma cruda con el perímetro de la cintura puede, por lo tanto, explicar en gran medida la asociación entre obesidad, insulina en ayunas, sensibilidad a la insulina y presión arterial al menos en ese estudio.
¿Qué mecanismos se esconden detrás de la presión arterial elevada encontrada con la obesidad visceral independiente de la resistencia a la insulina?
Una posible respuesta radica en la alteración de la secreción de angiotensina II y aldosterona en la obesidad.
La mayoría de los componentes del sistema renina-angiotensina han sido identificados en el tejido adiposo humano.
También se sabe que la obesidad causa alteraciones estructurales en los riñones que eventualmente pueden causar pérdida de la función de los nefrones y un aumento adicional de la presión arterial.
En efecto, se demostró que la deposición de grasa en el seno renal medida por tomografía computarizada (TC) es predictiva de hipertensión en el subestudio de imágenes del Estudio del Corazón de Framingham, un hallazgo que proporciona otra posible explicación para el vínculo entre la adiposidad visceral, los depósitos de grasa ectópica y el control de la presión arterial.
Por ende, la obesidad, especialmente la obesidad abdominal acompañada de deposición de grasa ectópica, parece jugar un papel importante en la fisiopatología de la hipertensión y no debe ser ignorada al determinar enfoques terapéuticos para reducir la presión arterial.
¿CÓMO LA GRASA ABDOMINAL AUMENTA EL RIESGO DE DIVERSOS TIPOS DE CÁNCER?

Datos epidemiológicos disponibles reiteraron la existencia de una asociación significativa entre la obesidad (IMC) y el aumento del riesgo de varios tipos de cáncer.
Estudios fundamentales han proporcionado evidencia significativa del aumento del riesgo de cáncer de colon, mama postmenopáusico, endometrial, renal, esofágico, hepático y pancreático, así como linfoma no Hodgkin y mieloma en individuos obesos.
Datos más recientes han mostrado una fuerte evidencia de un mayor riesgo de cáncer colorrectal, esofágico, renal y pancreático en ambos sexos, además de cáncer de tiroides en hombres y cáncer endometrial, de vesícula biliar y de mama postmenopáusico en mujeres.
La intervención para la pérdida de peso, principalmente en estudios basados en cirugía, parece revertir esta tendencia y reducir el riesgo de cáncer.
Como resultado, se ha establecido claramente un vínculo entre la obesidad y el riesgo de cáncer.
Los científicos han examinado si la adiposidad visceral está específicamente asociada con el riesgo de cáncer. Los datos más abundantes se relacionan con el cáncer colorrectal.
Varios estudios, incluido un meta-análisis, apoyan la noción de que la obesidad abdominal y/o visceral aumenta específicamente el riesgo de cáncer colorrectal independientemente de la adiposidad total.
La mayor acumulación de tejido adiposo visceral también parece predecir una peor respuesta al tratamiento de quimioterapia y mayores tasas de complicaciones como resultado de la cirugía.
No queda claro si las tasas de pólipos adenomatósicos, el precursor del cáncer colorrectal, están relacionadas con la obesidad abdominal.
La obesidad abdominal también parece estar relacionada posiblemente con el riesgo de cáncer de mama pre y postmenopáusico, riesgo de cáncer de próstata y cáncer esofágico.
También podría llevar a un peor resultado del tratamiento quirúrgico para el cáncer de páncreas.
Actualmente, se están investigando una gran cantidad de mecanismos para explicar el posible vínculo entre el cáncer y la obesidad/obesidad visceral.
APNEA DEL SUEÑO: DE LA GRASA ABDOMINAL A LOS PROBLEMAS RESPIRATORIOS DURANTE EL SUEÑO
El vínculo entre la apnea obstructiva del sueño y la obesidad ha sido reconocido desde hace mucho tiempo.
Por razones como la presión de las vías respiratorias superiores o la reducción de la distensibilidad del pecho relacionada con la acumulación de grasa en la parte superior del tronco, la adiposidad de la parte superior del cuerpo y, más específicamente, el exceso de adiposidad visceral también se ha asociado con la apnea obstructiva del sueño.
Dicha relación podría ser bidireccional; por un lado, la adiposidad visceral puede ser una característica del depósito ectópico de grasa, incluido el exceso de grasa en el cuello, que puede aumentar el riesgo de apnea obstructiva del sueño a través de fenómenos metabólicos y mecánicos.
Por otro lado, la apnea obstructiva del sueño también se asocia con un nivel reducido de actividad física, una calidad reducida del sueño y un aumento del apetito, y estos factores pueden aumentar aún más la susceptibilidad a la deposición de grasa visceral.
De ahí que, el individuo visceralmente obeso con apnea obstructiva del sueño puede entrar en un círculo vicioso que conduce a una marcada exacerbación de su condición clínica y perfil de riesgo cardiometabólico.
RIESGOS DEL SÍNDROME METABÓLICO ASOCIADOS CON LA GRASA ABDOMINAL

La constelación de anomalías asociadas con la obesidad o la obesidad abdominal se ha denominado “síndrome metabólico” y diversas organizaciones han propuesto una serie de criterios clínicos para ayudar a identificar a las personas de alto riesgo.
Aunque la circunferencia de la cintura fue inicialmente identificada como uno de los cinco criterios clínicos para diagnosticar el síndrome metabólico por el Programa Nacional de Educación sobre el Colesterol-Panel de Tratamiento de Adultos III, ha habido un debate sobre si esta característica debería ser un criterio clínico obligatorio tal como fue propuesto inicialmente por las directrices de la Federación Internacional de Diabetes.
La razón para no imponer la medición de la cintura como criterio obligatorio fue que algunos individuos podían caracterizarse por el síndrome metabólico a pesar de ser delgados.
Aunque la adiposidad visceral y las características del síndrome metabólico se asocian con un mayor riesgo relativo de ECV, no se puede utilizar un diagnóstico clínico del síndrome metabólico o una medición directa del tejido adiposo visceral (no es conveniente clínicamente) para estimar el riesgo de ECV.
Primero se debe evaluar el riesgo sobre la base de los factores de riesgo clásicos (edad, sexo, tabaquismo, presión arterial, colesterol LDL, colesterol HDL, antecedentes familiares de enfermedad coronaria prematura y otros).
Continúa siendo incierto si la obesidad abdominal y las características relacionadas del síndrome metabólico aumentan el riesgo global de ECV predicho por los factores de riesgo clásicos.
Por el momento, aunque los metaanálisis han demostrado que el síndrome metabólico aumenta el riesgo relativo de diabetes tipo 2 y ECV, no puede usarse como una estimación del riesgo de ECV sino más bien como una herramienta para enfatizar la necesidad de abordar el exceso de adiposidad abdominal mediante hábitos de vida adecuados (alimentación saludable y actividad/ejercicio físico).
La imposibilidad de utilizar el síndrome metabólico como calculadora de riesgo de ECV ha llevado a la introducción del concepto de riesgo cardiometabólico, que es simplemente el riesgo global de ECV resultante de la presencia de factores de riesgo tradicionales combinados con la posible contribución adicional de factores emergentes como la obesidad visceral/grasa ectópica y características del síndrome metabólico.
Comparte en tus redes sociales:
TE AGRADECEMOS QUE HAYAS LLEGADO HASTA AQUÍ, Y TE INVITAMOS A QUE NOS COMPARTAS TU OPINIÓN EN LA CAJA DE COMENTARIOS.
Artículos Recomendados
SÍNDROME METABÓLICO
SÍNDROME METABÓLICO: ¿QUÉ TAN MALO ES TENER SOBREPESO U OBESIDAD?
EL RENACIMIENTO DE TU CUERPO
DESCUBRE CÓMO EL BEBER AGUA PUEDE TRANSFORMAR TU BIENESTAR

LA CIENCIA DEL CALENTAMIENTO: CÓMO OPTIMIZAR EL RENDIMIENTO DEPORTIVO CON TÉCNICAS EFECTIVAS

¿CÓMO FUNCIONA LA RESPIRACIÓN DURANTE EL EJERCICIO FÍSICO? DESCUBRE LOS ÚLTIMOS HALLAZGOS CIENTÍFICOS

CALAMBRES MUSCULARES: ¿POR QUÉ OCURREN? ¿SOLO MOLESTOS O SÍNTOMAS DE ALGO MÁS GRAVE?

TODO SOBRE LA CREATINA: ¿QUÉ ES? ¿CÓMO FUNCIONA? ¿PARA QUÉ SIRVE? ¿ES SEGURA?

ENTRENAMIENTO HIIT: LA CLAVE PARA MEJORAR TU SALUD CARDIOVASCULAR RÁPIDAMENTE

¿POR QUÉ SUDAMOS? SUDOR, MECANISMO CRUCIAL PARA PRESERVAR TU BIENESTAR

¿POR QUÉ SIENTES FATIGA AL HACER EJERCICIO? LA CIENCIA DETRÁS DEL CANSANCIO