SÍNDROME METABÓLICO: ¿QUÉ TAN MALO ES TENER SOBREPESO U OBESIDAD?
Autor Chimalli Digital
¿QUÉ ES EL SÍNDROME METABÓLICO?
El síndrome metabólico es una epidemia silenciosa que supone un relevante problema de salud pública a escala global.
Dicho síndrome implica un conjunto de trastornos metabólicos como la dislipidemia, hipertensión y resistencia a la insulina que, habitualmente se relacionan con la acumulación central de la grasa.
Conforman un conjunto de factores de riesgo cardiovascular predictivos para el desarrollo de enfermedades cardiovasculares (ECV).
El síndrome metabólico facilita un aumento de 5 veces en el riesgo de desarrollar diabetes mellitus tipo 2, y un riesgo 2 veces mayor de padecer de alguna enfermedad cardiovascular en los próximos 5 a 6 años.
Un riesgo de 2 a 4 veces mayor de sufrir un accidente cerebrovascular, un riesgo de 3 a 4 veces mayor de sufrir un infarto de miocardio y un riesgo 2 veces mayor de morir a causa de dicho evento en comparación con personas saludables.
Se le conoce como “cuarteto mortal” al conjunto compuesto por la obesidad, intolerancia a la glucosa, hipertrigliceridemia e hipertensión tiene un origen multifactorial que aún no se comprende del todo.
No obstante, la predisposición genética y los factores ambientales han asumido un rol esencial en la puesta en marcha de dicho síndrome.

La alimentación y un estilo de vida sedentario también pueden jugar un rol importante en el desarrollo de desórdenes metabólicos.
En particular, la globalización de los patrones alimentarios y los crecientes niveles de sedentarismo juegan un rol significativo en este contexto.
Es por ello que el síndrome metabólico se ha tornado en el foco de diversos grupos de investigación e innumerables informes científicos en los últimos años.
Por sí misma, la relación contraproducente entre el volumen de conocimiento producido y la creciente prevalencia del síndrome metabólico es un argumento innegable para discutir dicha epidemia que ya no conoce barreras económicas ni socioculturales.
Paradójicamente, no hay una definición clínica acordada para el síndrome metabólico a pesar de que las definiciones existentes comparten los mismos criterios de diagnóstico.
Aún así, al tratarse de un síndrome, se acepta que el diagnostico requiere la asociación de, al menos, dos o más factores de riesgo de padecer alguna enfermedad cardiovascular.
El grupo de factores de riesgo para el desarrollo de enfermedades cardiovasculares se ha convertido en la definición más utilizada del síndrome metabólico.
Fue propuesto en 2009 por la FID y la Asociación Estadounidense del Corazón/Instituto Nacional del Corazón, los Pulmones y la Sangre en el último intento de unificar las definiciones existentes.
Sumado a ello, a pesar de las diferencias, todas las definiciones se basan en un sólido pilar formado por cuatro características principales: obesidad abdominal, hipertensión, dislipidemia y resistencia a la insulina.

Estos cuatro factores de riesgo se han convertido en el núcleo del síndrome metabólico, asumiendo un rol fundamental en su patología.
La Federación Internacional de Diabetes (FID) estima que aproximadamente una cuarta parte de la población mundial se ve afectada por el síndrome metabólico.
Una incidencia similar fue presentada por el Programa Nacional de Educación sobre el Colesterol (NCEP), que estima que la prevalencia del síndrome metabólico cubre más del 20% de las poblaciones adultas de los países occidentales.
La alta prevalencia del síndrome metabólico parece ser un punto común entre diferentes definiciones y poblaciones de todo el mundo.
El estilo de vida globalizado y desequilibrado, que antes estaba restringido a los países desarrollados, se ha convertido en un problema de salud mundial y en un objetivo principal del gasto público en atención sanitaria.
De hecho, se espera que la epidemia del síndrome metabólico y su grupo patógeno de factores de riesgo tengan un alto costo para los sistemas de salud pública en todo el mundo.
¿QUÉ CAUSA EL SÍNDROME METABÓLICO?
Comprender las raíces del síndrome metabólico, una mirada profunda a su fisiopatología
En consonancia con su definición, no existe un consenso respecto a la fisiopatología del síndrome metabólico, pero parece que el síndrome resulta de la compleja interacción entre factores genéticos y ambientales.
Pese a las numerosas investigaciones científicas en los últimos años que destacan el importante rol del tejido adiposo en los trastornos metabólicos centrales, su fisiopatología es multifacética y la compleja interacción entre los numerosos factores aún no está suficientemente clara.
Factores como el tejido adiposo visceral y su mediación endocrina, la hipertensión, la resistencia a la insulina y la dislipidemia, comprenden los principales pilares fisiopatológicos del síndrome.
En tiempos relativamente recientes, la disfunción endotelial, es estrés oxidativo crónico, la inflamación sistémica y los eventos aterotrombóticos también se han sumado como factores patogénicos esenciales.
Dichos factores clínicos “actuales” se unen a la susceptibilidad genética y los factores patogénicos clásicos para construir la fisiopatología compleja y multifacética del síndrome metabólico.
La contribución del tejido adiposo visceral en la patogénesis del síndrome metabólico es controvertida debido a las especificidades metabólicas relacionadas con su distribución.
Un importante conjunto de evidencias ha sugerido que la resistencia a la insulina parece preceder a la obesidad y específicamente a la acumulación del tejido adiposo visceral, ya que no todos los individuos obesos desarrollan resistencia a la insulina.

Aproximadamente entre el 10% y el 25% de los individuos obesos son metabólicamente sanos.
Adicionalmente, aunque la obesidad y la acumulación de grasa central son factores de riesgo importantes, los individuos con un índice de masa corporal (IMC) normal o ligeramente con sobrepeso también pueden presentar resistencia a la insulina.
Se ha reconocido que el depósito central de grasa es altamente dañino metabólicamente y se asocia continuamente con la resistencia a la insulina y enfermedades cardiovasculares.
La intervención del tejido adiposo visceral en los trastornos metabólicos del síndrome metabólico parece ser bien aceptada una vez que está positivamente más relacionada con la resistencia a la insulina que con la obesidad general.
La capacidad nociva del tejido adiposo visceral ha sido ampliamente discutida, pero parece centrarse en la modulación hormonal e inmunológica en estados de sobrepeso y obesidad en función de su capacidad endocrina.
Aunado a esto, la adiposidad visceral parece ser la principal fuente de ácidos grasos libres, primero al hígado (a través de la circulación esplácnica) y luego al sistema circulatorio.
El tejido adiposo visceral también es una fuente crucial de citocinas que participan activamente en la inducción de trastornos metabólicos relacionados con el síndrome metabólico.
El tejido adiposo disfuncional asociado con el tejido adiposo visceral da como resultado niveles y flujos elevados de ácidos grasos libres en plasma, lo que a su vez conduce a la deposición de lípidos ectópicos y a la lipotoxicidad.
La exposición crónica a altos niveles circulantes de ácidos grasos libres juega un rol crucial en la disfunción celular general del hígado, el páncreas y el músculo esquelético.
El hígado desempeña un rol esencial en las vías metabólicas de los lípidos mediante la captación de ácidos grasos libres séricos y la síntesis, almacenamiento y transporte de metabolitos lipídicos.
Normalmente, la respuesta del hígado a niveles elevados de ácidos grasos libres y también a otros lípidos plasmáticos como quilomicrones, lipoproteínas posprandiales y el colesterol de la dieta dan como resultado resistencia a la insulina hepática y acumulación local de lípidos probablemente mediada por la desregulación de la producción de glucosa hepática y el aumento de la lipogénesis hepática de novo.
En cuanto al páncreas, los altos niveles circulantes de ácidos grasos libres se han relacionado con daños estructurales y funcionales de las células beta (β), como estrés oxidativo del retículo endoplásmico y apoptosis celular que afecta la síntesis y secreción de insulina.
Teniendo en cuenta que la acumulación de tejido adiposo visceral no se asocia exclusivamente, sino típicamente, con la obesidad o el sobrepeso, es posible que el aumento de la demanda de insulina en estos estados induzca una sobrecarga y provoque una disfunción de las células β.
El tejido muscular muestra una respuesta similar a los niveles elevados y crónicos de ácidos grasos libres que se encuentran en las células hepáticas y β con acumulación ectópica de lípidos y resistencia a la insulina local.
Pese a que lo mecanismos exactos aún se desconocen, la acumulación de lípidos intramiocelulares es el probable precursor de la resistencia a la insulina local debido al aumento de la absorción de ácidos grasos relacionado con la sobrecarga crónica de lípidos y el deterioro de la beta-oxidación.
Adicionalmente, existen solidas evidencias de que la elevación de los ácidos grasos libres plasmáticos conduce a resistencia a la insulina mediante la inhibición del transporte y/o la fosforilación de la glucosa con una reducción posterior en las tasas de oxidación de la glucosa y la síntesis de glucógeno muscular.
Las adipocinas actúan centralmente para regular el apetito y el gasto energético, y periféricamente afectan la sensibilidad a la insulina, la capacidad oxidativa y la absorción de lípidos.
No obstante, el perfil de adipocinas cambia en respuesta a la cantidad y condición del tejido adiposo. La participación de las adipocinas en la fisiopatología del síndrome metabólico ha sido recurrente en la progresión de dicho síndrome tanto en animales como en humanos.
A pesar de ello, aunque se desconocen los mecanismos de sobreestimulación y secreción de adipocinas, los investigadores han logrado demostrar consistentemente que los niveles elevados de adipocinas juegan un rol central en la resistencia a la insulina y el establecimiento del síndrome relacionado con la obesidad.
Diversas hormonas derivadas del tejido adiposo secretadas en el sistema circulatorio, como la adiponectina y la resistina, pueden ser importantes para contribuir a la inflamación crónica, la resistencia a la insulina y el riesgo de padecer de alguna enfermedad cardiovascular.
De igual manera, Leal y su equipo de científicos sugieren que las adipocinas, liberadas por adipocitos o macrófagos infiltrados en el tejido adiposo en respuesta a la expansión de la masa grasa típica de la obesidad, inducen inflamación crónica de bajo grado, resistencia a la insulina y efecto aterogénico.
¿QUÉ ES LA RESISTENCIA A LA INSULINA?

La resistencia a la insulina se define como la incapacidad de una cantidad conocida de insulina exógena o endógena para aumentar la absorción de glucosa por las células, lo cual representa un factor de riesgo del síndrome metabólico.
Las personas con resistencia a la insulina pueden tener una distribución anormal de la grasa corporal con predominio en la parte superior del cuerpo, una característica altamente correlacionada con la resistencia a la insulina y el síndrome metabólico.
En las personas con síndrome metabólico, la obesidad no es una consecuencia de la resistencia a la insulina o la hiperinsulinemia, sino una variable fisiológica que disminuye la elevación de glucosa mediada por insulina un contribuyente patológico esencial.
INFLAMACIÓN, CUÁNDO LA GRASA SE CONVIERTE EN PROBLEMA

La inflamación parece ser el vínculo patogénico entre la obesidad y los trastornos metabólicos a través de la activación del sistema inmunológico.
El aumento de células inmunes como macrófagos y proteínas de fase aguda, como la proteína C reactiva, en el tejido adiposo, modula la producción de citocinas hacia un perfil proinflamatorio y el silencioso establecimiento de un estado inflamatorio de bajo grado.
El estado inflamatorio de bajo grado se relaciona regularmente con trastornos del metabolismo energético, especialmente daños y trastornos del metabolismo de la insulina en los tejidos periféricos.
De hecho, la pérdida de control homeostático inflamatorio se ha asociado cada vez más con la resistencia a la insulina muscular, la falla en la producción y secreción de insulina relacionada con la pérdida de células β.
Así como con daño hepático como cirrosis, sepsis e incluso insuficiencia hepática aguda debido a la supresión de la capacidad regenerativa.
¿QUÉ ES LA HIPERTENSIÓN?
La hipertensión es una elevación transitoria o sostenida de la presión arterial sistémica que puede inducir daño cardiovascular y otros efectos adversos.
Se caracteriza por valores de presión arterial iguales o superiores a 130/85 mm de mercurio en reposo y esta relacionado con diversas anomalías antropométricas y metabólicas.
La evidencia indica que la hipertensión afecta aproximadamente al 85% de los pacientes con síndrome metabólico, y el 50% de dichos pacientes son resistentes a la insulina.
No obstante, pese a la asociación de la resistencia a la insulina, la obesidad y el síndrome metabólico están innegablemente relacionados con la hipertensión en un círculo vicioso dañino, donde la obesidad parece jugar un rol esencial en la etiología del síndrome relacionado con la hipertensión.
Algunos posibles factores como la obesidad visceral, la resistencia a la insulina, el estrés oxidativo, la disfunción endotelial, la activación del sistema renina-angiotensina, el aumento de mediadores inflamatorios y la apnea obstructiva pueden desencadenar hipertensión por el síndrome metabólico.
Dichos factores pueden producir hiperactividad simpática, vasoconstricción, aumento del líquido intravascular y disminución de la vasodilatación, lo que contribuye al desarrollo de la hipertensión en el síndrome metabólico.
Aunque se requiere de mayor investigación, idealmente utilizando grandes poblaciones de pacientes para comprender mejor los mecanismos fisiopatológicos subyacentes detrás del síndrome, existe un acuerdo general en que la obesidad visceral y la resistencia a la insulina son el núcleo de la mayoría de los casos de síndrome metabólico.
La resistencia a la eliminación de glucosa mediada por insulina determina la hiperinsulinemia compensatoria para mantener la homeostasis de la glucosa.
Al fin y al cabo, este mecanismo adaptativo puede promover la hipertensión y diversos procesos aterogénicos mediante mecanismos pendientes por descubrir.
La obesidad visceral también induce la producción de muchas adipoquinas que hacen que la disfunción barorrefleja sea una parte esencial de la etiología de la hipertensión.
La desregulación de las adipocinas y el consiguiente aumento de la inflamación sistémica se unen a la compleja red de mecanismos que alteran la homeostasis vascular (desequilibrio entre las vías del óxido nítrico y la endotelina) y perjudican la vasodilatación dependiente del endotelio estimulada por la insulina.
La producción anormal de adipoquinas y la infiltración de macrófagos en el tejido adiposo visceral también se han señalado como posibles factores responsables del incremento en la producción de especies reactivas de oxígeno y estrés oxidativo relacionado.
Estando ambos factores directamente relacionados con la activación central de la actividad nerviosa simpática en un ciclo de retroalimentación positiva.
De hecho, las especies reactivas de oxigeno son importantes señalizadores celulares que participan directamente en la desregulación del equilibrio autónomo y, en consecuencia, en el control de la presión arterial.
¿QUÉ NOS HACE VULNERABLES? FACTORES DE RIESGO PARA EL SÍNDROME METABÓLICO
EL ADN DE LA SALUD: DESCUBRIENDO EL FACTOR GENÉTICO DETRÁS DEL SÍNDROME METABÓLICO
Pese a la fuerte asociación entre el síndrome metabólico y la obesidad, con su grupo de factores de riesgo, algunas personas y grupos étnicos tienen una incidencia alta y paradójica del síndrome metabólico.
Con un paradigma similar, recientemente se ha reconocido que un número significativo de individuos obesos no expresan trastornos metabólicos ni factores de riesgo cardiovascular, lo cual indica que la etiología del síndrome parece ir más allá de la influencia de los factores de riesgo.
Los datos de 314 adultos blancos de la parte sur de Alemania, en los que se midió la grasa corporal total (visceral y subcutánea) con tomografía por resonancia magnética y la grasa en el hígado y el músculo esquelético con espectroscopia de resonancia magnética de protones, evidenciaron que una obesidad metabólicamente benigna no va acompañada de resistencia a la insulina y aterosclerosis temprana.
Realmente, es probable que la sensibilidad metabólica a diferentes factores ambientales pueda estar bajo control genético.
La predisposición genética puede explicar por qué los sujetos delgados, como los grupos étnicos del sur de Asia o los individuos obesos metabólicamente sanos, son o no, respectivamente, más propensos a desarrollar el síndrome metabólico.
La predisposición genética a factores de riesgo específicos se ha relacionado con diferentes tipos de polimorfismos genéticos y se ha vinculado a procesos metabólicos como las lipoproteínas y el metabolismo de la insulina.
Wang y su equipo de investigadores proporcionaron evidencia genética que respalda la hipótesis de que la variante del exón 8 del gen del receptor de insulina está asociada con la patogénesis del síndrome metabólico en la población china.
Sumado a ello, la predisposición genética al síndrome metabólico fue corroborada por un estudio científico de Chiefari y su equipo de investigadores, que demuestra que una variante del gen HMGA1, concretamente la variante rs146052672, es un locus de susceptibilidad importante que confiere un alto riesgo de desarrollo del síndrome metabólico y predispone a los rasgos antropométricos y metabólicos desfavorables de dicho trastorno.
A ello se añade, la predisposición genética también parece estar modulada por el entorno en diferentes etapas de desarrollo, como lo propone la hipótesis del fenotipo ahorrativo.
Sugerida por primera vez por Neel en 1962 y posteriormente por Hales y Barker en 1992, la hipótesis propuso que los ambientes restrictivos o con una ingesta energética inestable en las fases intrauterinas favorecen un fenotipo de preservación de energía.
Dicho patrón genético inicialmente favorable en ambientes restrictivos se vuelve desventajoso cuando las condiciones alimentarias mejoran, apoyando el desarrollo de patologías relacionadas con el desequilibrio energético debido a sus características ahorrativas moduladas en estados de restricción alimentaria.
Diferentes estudios científicos también señalan la heredabilidad como indicador de la susceptibilidad genética y factor patogénico decisivo.
En una extensa revisión, van Dongen y su equipo de científicos estimaron la influencia genética sobre los componentes del síndrome metabólico, basándose en una serie de estudios.
De acuerdo a los autores, la influencia genética puede variar del 24% al 90% para el IMC, del 10% al 75% para la glucemia en ayunas y del 0.03% al 72% para los triglicéridos dentro de otros parámetros.
COMER BIEN Y MOVERSE, CLAVES PARA PREVENIR EL SÍNDROME METABÓLICO: FACTOR AMBIENTAL
EL PODER DE LOS ALIMENTOS, CÓMO LA DIETA MOLDEA EL DESTINO DEL SÍNDROME METABÓLICO
La dieta juega un rol esencial en el desarrollo del síndrome metabólico.
Aparte de estar directamente relacionados con el balance energético, los nutrientes por su propia naturaleza pueden tener un carácter proinflamatorio ya que su procesamiento puede producir moléculas biológicas que desencadenan una respuesta inflamatoria.
Teniendo en cuenta esto, se espera que el consumo excesivo de nutrientes (especialmente conjugado con un estado de sobrenutrición), además de inducir sobrepeso y obesidad, puede exacerbar aún más el proceso inflamatorio, conduciendo a un ciclo dañino capaz de comprometer el metabolismo de la insulina.
De hecho, la evidencia ha demostrado una relación patogénica entre ciertos patrones dietéticos y el excedente calórico y el desarrollo de enfermedades crónicas como la diabetes.
La cantidad y calidad de la grasa consumida también tienen repercusiones importantes en el grupo de síndromes de anomalías metabólicas.
Existe evidencia de que el intercambio de grasas saturadas en la dieta con grasas monoinsaturadas y/o poliinsaturadas produce efectos beneficiosos sobre el control metabólico.
Como disminución de las concentraciones de colesterol LDL, mejora del perfil lipídico posprandial, reducción de la presión arterial y mejora de la sensibilidad a la insulina.
En cambio, el consumo a largo plazo de altas concentraciones calóricas basadas en altas concentraciones de grasas saturadas está relacionado con el almacenamiento intracelular de grasa y lipotoxinas derivadas de grasas capaces de inducir resistencia a la insulina.
En particular en el músculo esquelético, el tejido hepático y pancreático, principales órganos de captación de glucosa posprandial y mantenimiento de los niveles de glucosa homeostáticos.
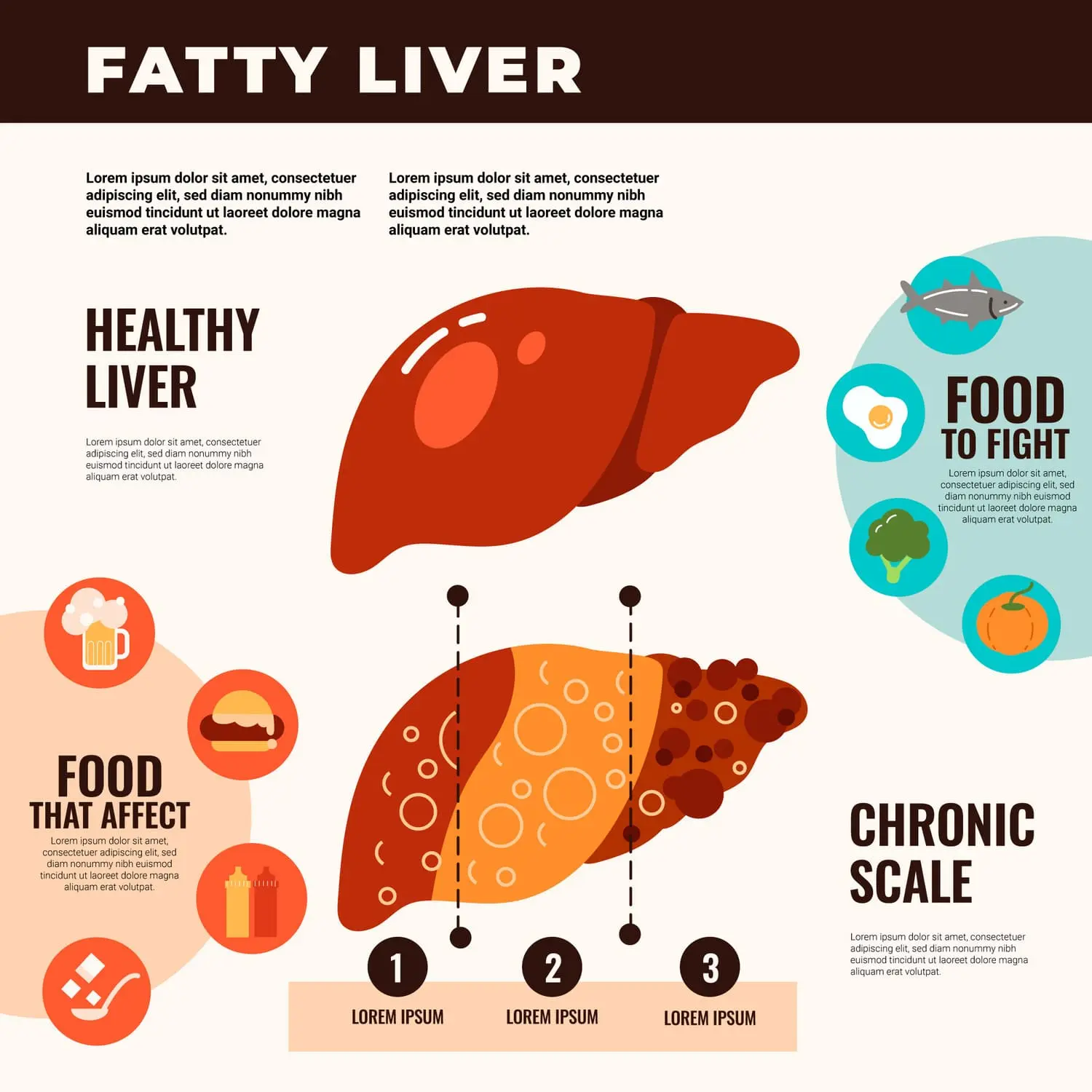
Los mecanismos de deterioro de las vías de señalización de la insulina y los consiguientes trastornos en el metabolismo de la glucosa relacionados con la lipotoxicidad son similares, pero no idénticos en esos tejidos.
En tanto que la acumulación de ácidos grasos hepáticos impide su conversión en triglicéridos, lo que lleva a la acumulación de diacilglicerol, la sobrecarga de la capacidad oxidativa muscular da como resultado la acumulación de moléculas de ceramida.
No obstante, las desviaciones en las vías de señalización de la insulina en el tejido muscular se asocian más con la acumulación de diacilglicerol y acil-CoA, en lugar del almacenamiento de triglicéridos y ceramidas.
El aumento de la concentración intracelular de diacilglicerol disminuye la síntesis de glucógeno muscular y hepático, respectivamente, lo que se relaciona con una disminución de la translocación de GLUT4 a la membrana de las células musculares y la inhibición de la enzima glucógeno sintasa con el consiguiente aumento de la gluconeogénesis hepática, tal como lo planteo Erion y su equipo de investigadores.
Dichos investigadores señalan cuatro mecanismos principales para la acumulación de diacilglicerol: consumo excesivo de calorías, anomalías en el metabolismo de los adipocitos (almacenamiento de lípidos y estimulación de la lipólisis), defectos en la oxidación mitocondrial de los ácidos grasos y susceptibilidad genética con repercusiones en la inhibición de la enzima LPL.
DEL SÓFA AL SÍNDROME METABÓLICO: CÓMO EL COMPORTAMIENTO SEDENTARIO IMPACTA EN LA SALUD
El sedentarismo o conductas/actividades sedentarias no tiene una definición consensuada.
Comúnmente se ha definido como “cualquier conducta/actividad caracterizada por un gasto de energía menor o igual a 1.5 MET (Unidad Metabólica de Reposo), predominantemente en posición sentada”.
No obstante, es importante enfatizar que el sedentarismo no implica la falta de actividad física, sino más bien un predominio de conductas sedentarias a lo largo del día, como trabajar, conducir o mirar televisión.
Por ejemplo, es posible alcanzar las recomendaciones diarias de actividad física moderada/vigorosa y ser muy sedentario durante todo el ciclo diario dado el tiempo sentado en el trabajo o descansando.
Las tendencias actuales relacionadas con el estudio del sedentarismo han indicado que las actividades sedentarias y las recomendaciones diarias de actividad física suelen coexistir, incluso en el ciclo diario de un individuo activo.
Pese a ello, Owen y su equipo de científicos enfatizan que el sedentarismo solo es significativo si el tiempo dedicado a conductas sedentarias contribuye a la reducción del tiempo total diario de actividad física.
Los efectos adversos del sedentarismo son innegables en el perfil clínico de un individuo.
El predominio del sedentarismo se convirtió en sí mismo en un factor de riesgo de muerte prematura independiente del sexo y del tipo de actividad física practicada por un individuo.
De hecho, se ha demostrado que un estilo de vida sedentario tiene un impacto directo en la esperanza de vida debido a la mortalidad por todas las causas, pero principalmente por enfermedad cardiovascular inducida por alteraciones metabólicas nocivas comúnmente encontradas en perfiles diabetogénicos y aterogénicos.
Afectando particularmente a los marcadores de riesgo cardiometabólico como el IMC, circunferencia de cintura, presión arterial, TGC, colesterol HDL, glucosa plasmática en ayunas y poscarga e insulina en ayunas como lo muestran Thorp y su equipo de investigadores en el estudio australiano sobre diabetes, obesidad y estilo de vida.
De igual manera, la falta de contracción muscular parece ser el principal factor perjudicial del sedentarismo para el perfil cardiometabólico, induciendo el metabolismo de la glucosa y trastornos del aclaramiento de triglicéridos.
Los estudios en la población general han evidenciado la relación perjudicial entre el estilo de vida sedentario y la disminución de la esperanza de vida, especialmente los estudios sobre las consecuencias para la salud cardiometabólica del tiempo prolongado sentado.
De acuerdo con un seguimiento de 8 800 adultos durante aproximadamente siete años, Dunstan y su equipo de investigadores encontraron que cada hora pasada frente a la televisión aumentaba en un 11% el riesgo de muerte por todas las causas y en un 18% el riesgo de muerte por enfermedad cardiometabólica.
Tomando en cuenta el importante número de trabajadores en todo el mundo que pasan hasta el 70% de su tiempo diario sentados, los 3.2 millones de muertes prematuras relacionadas con el sedentarismo estimadas por la OMS no son sorprendentes sino más bien esperadas.
El sedentarismo no forma parte del grupo de factores de riesgo del síndrome metabólico, sin embargo, esta muy relacionado con el desarrollo de comorbilidades comunes como diabetes, enfermedades cardiovasculares, cáncer, mayor riesgo de muerte prematura y disminución de la esperanza de vida.
En contraste, los hallazgos continuos han demostrado consistentemente el potencial beneficioso de la actividad física regular en el tratamiento del síndrome metabólico.
Se han asociado diversos mecanismos potenciales con la práctica regular de actividad física a lo largo del tiempo, incluida la mejora de la composición corporal, principalmente en la reducción de la adiposidad abdominal.
Mejora del metabolismo de la glucosa y homeostasis debido a una mayor absorción de glucosa y una mayor sensibilidad a la insulina; mejora del perfil de lipoproteínas y lípidos; y posteriormente mejoras en la presión arterial.
Siendo importante enfatizar que la efectividad de la actividad física en el manejo del síndrome metabólico parece depender de su intensidad, duración y frecuencia.
Las recomendaciones globales sobre actividad física para la salud de la OMS recomiendan para adultos entre 18 y 64 años una práctica semanal de al menos 150 minutos de actividad física aeróbica de intensidad moderada.
O, al menos, una práctica semanal de 75 minutos de actividad física aeróbica de intensidad vigorosa o incluso una combinación equivalente de ejercicio físico de intensidad moderado y vigoroso.
No obstante, se pueden encontrar diferentes recomendaciones en diversos artículos científicos relacionados con el ejercicio físico y la salud.
Entre las tendencias actuales en el manejo del síndrome metabólico, han ganado protagonismo los programas de entrenamiento compuestos por ejercicios de alta intensidad y corta duración.
De hecho, diversos estudios científicos que utilizan el conocido HIIT (entrenamiento en intervalos de alta intensidad) con diferentes intensidades han mostrado resultados prometedores en la reducción del síndrome metabólico y sus componentes.
Lee y su equipo de científicos han demostrado los efectos beneficiosos de la actividad física moderada incluso en ausencia de pérdida de peso, con reducciones significativas en la grasa total y abdominal en hombres adultos, independientemente del peso corporal previo y los niveles de actividad física.
El impacto beneficioso de la actividad física se puede atribuir a su efecto antiinflamatorio, un efecto probablemente resultante de la reducción de la hipoxia en el tejido adiposo debido a mejoras en el flujo sanguíneo y la densidad capilar.
Comparte en tus redes sociales:
TE AGRADECEMOS QUE HAYAS LLEGADO HASTA AQUÍ, Y TE INVITAMOS A QUE NOS COMPARTAS TU OPINIÓN EN LA CAJA DE COMENTARIOS.
Artículos Recomendados
IMC
DESMITIFICANDO EL ÍNDICE DE MASA CORPORAL ¿ES REALMENTE UN INDICADOR PRECISO DE SALUD? Y ¿POR QUÉ ES TAN USADO?

LA CIENCIA DEL CALENTAMIENTO: CÓMO OPTIMIZAR EL RENDIMIENTO DEPORTIVO CON TÉCNICAS EFECTIVAS

¿CÓMO FUNCIONA LA RESPIRACIÓN DURANTE EL EJERCICIO FÍSICO? DESCUBRE LOS ÚLTIMOS HALLAZGOS CIENTÍFICOS

CALAMBRES MUSCULARES: ¿POR QUÉ OCURREN? ¿SOLO MOLESTOS O SÍNTOMAS DE ALGO MÁS GRAVE?

TODO SOBRE LA CREATINA: ¿QUÉ ES? ¿CÓMO FUNCIONA? ¿PARA QUÉ SIRVE? ¿ES SEGURA?

ENTRENAMIENTO HIIT: LA CLAVE PARA MEJORAR TU SALUD CARDIOVASCULAR RÁPIDAMENTE

¿POR QUÉ SUDAMOS? SUDOR, MECANISMO CRUCIAL PARA PRESERVAR TU BIENESTAR

¿POR QUÉ SIENTES FATIGA AL HACER EJERCICIO? LA CIENCIA DETRÁS DEL CANSANCIO